Scheikunde
Table of contents
Atomen
Atomen zijn de bouwblokken van stoffen. Ze bestaan uit:
- Protonen (+)
- Neutronen (0)
- Elektronen (-)
Het aantal protonen (aka atoomnummer) bepaald om welke soort atoom het gaat.
In de kern van een atoom zitten de protonen en neutronen. Daaromheen bewegen de elektronen in orbitalen. Er zijn evenveel elektronen als protonen, waardoor een atoom ongeladen is.
In het periodiek systeem staan drie belangrijke getallen:
- De relatieve atoommassa (rechtsboven) is de som van het aantal protonen en neutronen.
- Het atoomnummer (naast de letter) is het aantal protonen.
- De elektronenconfiguratie (linksonder) geeft het aantal elektronen per orbitaal aan.
De massa van atomen wordt gemeten met de atomaire massaeenheid (u). Protonen en neutronen wegen allebei precies 1u. Elektronen hebben een verwaarloosbaar kleine massa.
Er zijn twee soorten atomen: metalen en niet-metalen. Met uitzondering van koolstof geleiden niet-metalen geen stroom.
Periodiek systeem
Het periodiek systeem is een stelsel om atoomsoorten mee te categoriseren. Het is opgedeeld in rijen (periodes) en kolomen (groepen). Atoomsoorten die in het periodiek systeem onder elkaar staan lijken chemisch op elkaar.
- Akalimetalen (groep 1) reageren heftig met water.
- Halogenen (groep 17) komen veel voor als negatief geladen ionen.
- Edelgassen (groep 18) zijn saai en reageren nooit (boring!)
Isotopen (overschot of tekort aan neutronen)
De atoomkern (protonen + neutronen) vormt het grootste deel van de massa van een atoom, omdat elektronen een bijna verwaarloosbaar kleine massa hebben.
Voor een atoomsoort is het atoomnummer (aantal protonen) altijd constant, maar het aantal neutronen kan variëren. Daardoor kunnen er verschillende isotopen zijn van een stof, met elk een net andere atoommassa.
De relatieve atoommassa in het periodiek systeem is een gewogen gemiddelde van alle natuurlijk voorkomende isotopen.
Ionen (overschot of tekort aan elektronen)
Een ion is een geladen atoom. Ionisatie is alleen mogelijk door het toevoegen of wegnemen van elektronen, want het aantal protonen in een atoom is (zonder kernreacties) onveranderlijk.
Als je energie toevoert aan een atoom kan je elektronen uit de buitenste orbitaal vrijmaken. Hoe voller de buitenste schil, hoe moeilijker het is om een atoom te ioniseren, en hoe hoger de ionisatie-energie dus.
- Bij een edelgas is de buitenste schil verzadigd, dus is ionisatie moeilijk, en daarom zijn edelgassen niet reactief.
- De halogenen hebben missen één elektron in de buitenste schil, en komen daarom vooral als negatief geladen ionen voor.
- De akalimetalen hebben maar één elektron is de buitenste schil, dus zijn makkelijk te ioniseren en dus zeer reactief.
De valentie-elektronen (val-e-) van een atoom zijn de elektronen in de buitenste schil. Dit zijn de elektronen die bindingen vormen. Stoffen die onder elkaar staan in het periodiek systeem hebben evenveel val-e-.
De lading die wordt veroorzaakt door het toevoeren of afnemen van elektronen noemen we formele lading. Je berekent deze door:
\[\text{lading} = \text{val } e^- - \text{niet-bindende } e^- - \text{aantal bindingen}\]
Moleculen en bindingen
Atomen ‘streven’ naar edelgasconfiguratie omdat die het meest stabiel is. Om hun buitenste orbitaal volledig te vullen gaan ze reacties aan. Daardoor worden moleculen gevormd.
Stoffen blijven bij elkaar door bindingen:
| Soort stof | Naam binding | bestaat uit |
|---|---|---|
| Moleculaire stof | Covalente binding of atoombinding | niet-metalen |
| Metaalrooster | Metaalbinding | metaalionen |
| Zoutrooster | Ionbinding | niet-metaalionen en metaalionen |
Moleculaire stoffen
Bij een moleculaire stof is er sprake van gemeenschappelijke elektronenparen. Daarbij delen atomen de elektronen in hun buitenste schil. Daardoor hebben ze beide een edelgasconfiguratie.
Stel je hebt water (\(\ce{H2O}\)). Het zuurstofatoom heeft 6 val-e-. De waterstoffen hebben allebei 1 val-e-. Waterstof heeft één elektron te weinig voor edelgasconfiguratie, en zuurstof heeft er twee te weinig:

Deze stoffen kunnen hun elektronen ‘delen’; dan doen de elektronen mee in beide buitenste schillen. Dit noemen we covalentie (het delen van lading). De elektronen vormen dan een covalente binding tussen de atomen.
Het aantal covalente bindingen die een stof aan kan gaan hangt dus af van het aantal val-e- in de buitenste orbitaal. Voor veelvoorkomende stoffen is dat:
| Atoom | C | N | O | F | H |
|---|---|---|---|---|---|
| aantal bindingen | 4 | 3 | 2 | 1 | 1 |
Metalen
- Edele metalen zijn weinig reactief en kunnen dus zuiver in de bodem voorkomen.
- Onedele metalen komen alleen voor als bindingen of ionen; je hebt een reactie nodig om het metaal uit een erts te krijgen.
Metaalatomen kunnen metaalroosters vormen. In een rooster zijn alle metaalatomen volledig geioniseerd, en kunnen de elektronen zich vrij bewegen. De ionen blijven bij elkaar doordat de lading van de vrije elektronen de positief geladen atoomkernen aantrekt.
De vrije elektronen kunnen kinetische energie en lading verplaatsen; metalen geleiden dus stroom en warmte.
Zouten
Zouten zijn roosters gevormd uit ionen van metalen en niet-metalen, waarbij typisch de metalen positief en de niet-metalen negatief geladen zijn*. De ionen blijven bij elkaar door de elektrostatische interactie tussen de ionen (aka gelijke tegengestelde lading trekt elkaar aan).
| Metaal | Lading |
|---|---|
| \(\ce{KNaAg}\) | 1+ |
| \(\ce{Fe}\) | 2+ of 3+ |
| \(\ce{Al}\) | 3+ |
| De rest | 2+ |
Zouten zelf zijn altijd elektrisch neutraal. Daarom kunnen twee stoffen altijd maar in één vaste verhouding een zout vormen, en laten we in systematische namen de voorvoegsels mono-, di-, tri-, tetra-, penta-, en hexa- weg.
Zouten zijn bij kamertemperatuur vast, en de ionen zitten dan op een vaste plaats in het ionrooster. Daardoor geleiden zouten in vaste vorm geen stroom.
In zoutoplossingen kunnen de ionen wel vrij bewegen. Opgelost in water geleiden zouten dus wel stroom.
| Lading | Naam | Formule |
|---|---|---|
| 1+ | Ammonium | \(\ce{NH4+}\) |
| 1- | Hydroxide | \(\ce{OH-}\) |
| Nitraat | \(\ce{NO3-}\) | |
| Nitriet | \(\ce{NO2-}\) | |
| Waterstofcarbonaat | \(\ce{HCO3-}\) | |
| Acetaat/ethanoaat | \(\ce{CH3COO-}\) | |
| 2- | Carbonaat | \(\ce{CO3^2-}\) |
| Sulfaat | \(\ce{SO4^2-}\) | |
| Sulfiet | \(\ce{SO3^2-}\) | |
| 3- | Fosfaat | \(\ce{PO4^3-}\) |
| Fosfiet | \(\ce{PO3^3-}\) |
*\(\ce{NH4+}\) is een uitzondering.
Polariteit
Polariteit is een verschijnsel dat zich voordoet bij covalentie. In een apolaire covalente binding draaien de gedeelde elektronen afwisselend mee in de buitenste orbitaal van beide stoffen:
In een polaire binding (aka een dipool) ziet dat er meer zo uit:
De ‘gedeelde’ elektronen bevinden zich voornamelijk in de orbitalen van \(\ce{F}\) en slechts af en toe in de buitenste schil van het \(\ce{H}\)-atoom.
Electronegatieve atomen zoals \(\ce{F}\) trekken de covalentebinding naar zichzelf toe. Daardoor wordt het electronegatieve atoom een beetje negatief geladen (\(\ce{\delta-}\)), en het andere atoom een beetje positief geladen (\(\ce{\delta+}\)). We noemen dit partiële lading.
De electronegatieve atomen kan je onthouden met het ezelsbruggetje \(\ce{FONClBrI}\).
Stoffen en mengsels
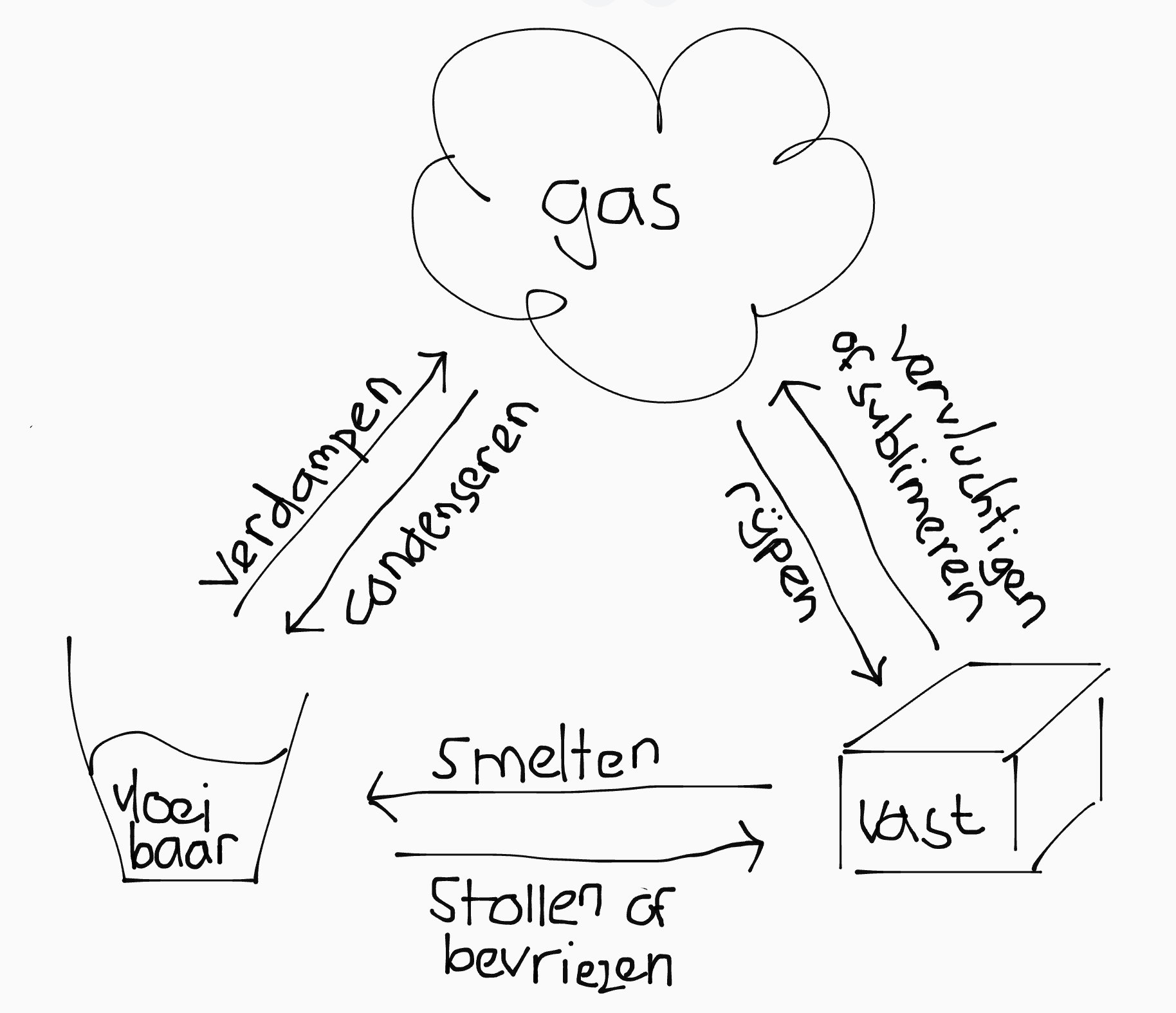
Fases en faseovergangen
Stoffen kunnen afhankelijk van de temperatuur in drie fases voorkomen:
| Fase | Deeltjesmodel |
|---|---|
| Vast | Statisch, op een vaste plek. |
| Vloeibaar | Vrij, maar deeltjes hebben onderling een aantrekkende werking. |
| Gas | Grotere tussenliggende ruimte en weinig onderlinge invloed. |
Stofeigenschappen
- Fase bij kamertemperatuur
- Dichtheid
- Oplosbaarheid
- Aanhechtingsvermogen
- Kleur
- Geur
Micro- en macroniveau
Je kan stofeigenschappen op twee niveaus indelen:
- Micro: eigenschappen van en interacties tussen de deeltjes waaruit een stof bestaat.
- Macro: eigenschappen en processen die wij zintuigelijk kunnen waarnemen. Het gedrag op macroniveau is altijd een voortvloeistof van stofeigenschappen op microniveau.
Mengsels
| Naam | mengsel van | helder? |
|---|---|---|
| Oplossing | Goed oplosbare vaste stof in een vloeistof. | helder |
| Suspensie | Slecht oplosbare vaste stof in een vloeistof. | troebel |
| Legering | Twee of meer verschillende metalen. | troebel |
| Schuim | Kleine gasbelletjes in een vaste stof. | troebel |
| Rook | Vaste stoffen in een gas. | troebel |
| Mist | Vloeistoffen in een gas. | troebel |
| Emulsie | Slecht mengbare stoffen (langdurig dankzij een emulgator). | troebel |
Een mengsel heeft smelt- en kooktrajecten, een zuivere stof heeft smelt- en kookpunten (te herkennen aan een horizontaal stuk in de grafiek).
| Mengsel | Zuivere stof |
|---|---|
 |
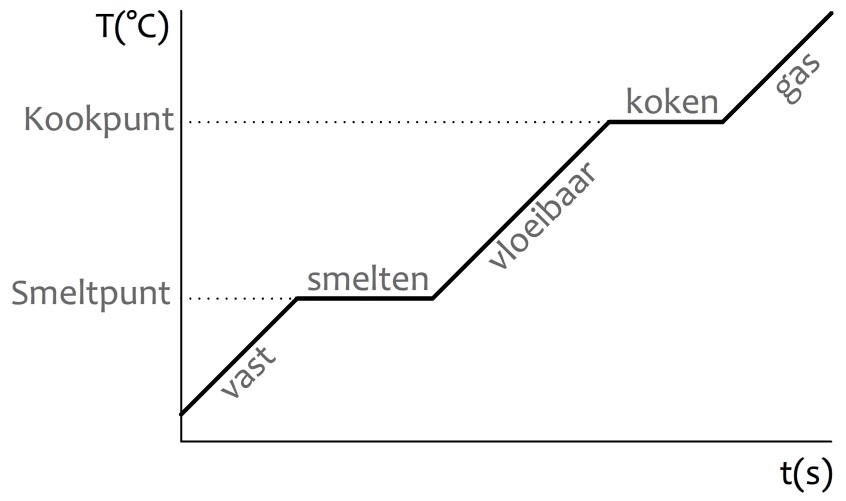 |
Scheidingsmethodes
| Naam | mengsel | berust op |
|---|---|---|
| Filtreren | suspensie | deeltjesgrootte |
| Adsorberen | oplossing of gasmengsel | aanhechtingsvermogen |
| Indampen | oplossing of suspensie | kookpunt |
| Extraheren | mengsel van vaste stoffen | oplosbaarheid |
| Zeven | suspensie of mengsel van vaste stoffen | deeltjesgrootte |
| Destilleren | goed mengbare vloeistoffen | kookpunt |
| Centrifugeren | suspensie of emulsie | dichtheid |
| Bezinken & afschenken | suspensie of emulsie | dichtheid |
| Chromatografie | oplossing of suspensie | aanhechtingsvermogen en oplosbaarheid |
Chemisch rekenen
Dichtheid
De dichtheid (\(\rho\)) geeft het verband tussen de massa (\(m\)) en het volume (\(V\)) van een stof:
\[\rho = \frac{m}{V}\]
Chemische hoeveelheid
Om te rekenen met stoffen moeten we rekening houden met het feit dat niet alle moleculen even zwaar zijn. Maar werken met individuele molecuulmassa’s is onbegonnen.
Daarom gebruiken we de chemische hoeveelheid (\(n\)), een maat voor \(6.022 \cdot 10^{23}\) moleculen (getal van Avogadro). Dit getal is zo gekozen dat de massa van 1 mol van een stof in gram exact gelijk is aan de molecuulmassa van één molecuul in u (de molaire massa).
\[M_{\ce{H2O}} = 18.015 \text{u} = 18.015 \text{g/mol}\]
Omrekenen tussen massa en chemische hoeveelheid gaat via de molaire massa:
\[M = \frac{m}{n}\]
Concentratie
De concentratie (\(c\)) is de hoeveelheid van een stof die zich in het volume van een medium, zoals een oplossing of gasmengsel, bevindt.
\[c = \frac{n}{L} \text{ } \text{ of } \text{ } c = \frac{m}{L}\]
We noteren concentraties vaak tussen vierkante haken. Daarnaast hebben gebruiken we vaak de eenheid molair (M) als afkorting voor mol/L. We spreken dan ookwel van molariteit.
\[\ce{[H3O+]} = 1.000 \text{M } \text{ } \longleftrightarrow \text{ } \text{ }c_\ce{H3O+} = 1.000 \text{mol/L}\]
Krachten
Bindingen zorgen ervoor dat atomen in moleculen bij elkaar blijven. De krachten tussen de moleculen zorgen ervoor dat moleculen in stoffen bij elkaar blijven.
Als de krachten te zwak zijn om een stof bij elkaar te houden vindt er een faseovergang plaats. Dus, hoe groter de onderlinge krachten tussen moleculen, hoe hoger de smelt- en kookpunten.
Er zijn drie, steeds sterkere, krachten die stoffen bij elkaar houden: VDW, dipool-dipool en \(\ce{H}\)-bruggen.
Vanderwaals
De vanderwaalskracht is een aantrekkende kracht tussen alle moleculen. Hoe groter de molecuulmassa, hoe groter de aantrekkende kracht. Van de drie krachten is dit de zwakste.
Polariteit (aka dipool-dipoolinteractie)
Atomen met een tegengestelde partiële lading trekken elkaar aan. Dat noemen we dipool-dipoolinteractie. Deze aantrekkende kracht houdt polaire moleculen bij elkaar.
Waterstofbruggen
De \(\ce{H}\)-brug is een sterke variant van dipool-dipoolinteractie. Waterstofbruggen kunnen ontstaan bij moleculen met een \(\ce{OH}\)- of \(\ce{NH2}\)-groep.
Waterstofbruggen vormen door de aantrekking tussen het \(\ce{\delta+}\)-geladen \(\ce{H}\)-atoom van de \(\ce{OH}\)- of \(\ce{NH2}\)-groep en de ongebonden elektronenparen van een willekeurige \(\ce{O}\) of \(\ce{N}\). Een \(\ce{O}\)-atoom heeft twee ongebonden elektronenparen en kan dus twee waterstofbruggen hebben; een \(\ce{N}\)-atoom maar één.
Er kunnen ook waterstofbruggen vormen vanaf de \(\ce{H}\) van \(\ce{HF}\).
Reacties
Reactie-energie (aka energie-effect)
Het kost een bepaalde energie om een binding tussen moleculen te maken of af te breken.
Als er een reactie tussen stoffen plaatsvindt, moeten alle bindingen links van de pijl afgebroken worden, en rechts van de pijl gevormd worden. Daaruit volgt:
\[\Delta E = -E_{\text{beginproducten}} + E_{\text{eindproducten}}\]
De \(E\) van de begin- of eindproducten bereken je door de som te nemen van de vormingswarmten uit Binas 57A.
| Exotherm: \(\Delta E < 0\) | Endotherm: \(\Delta E > 0\) |
|---|---|
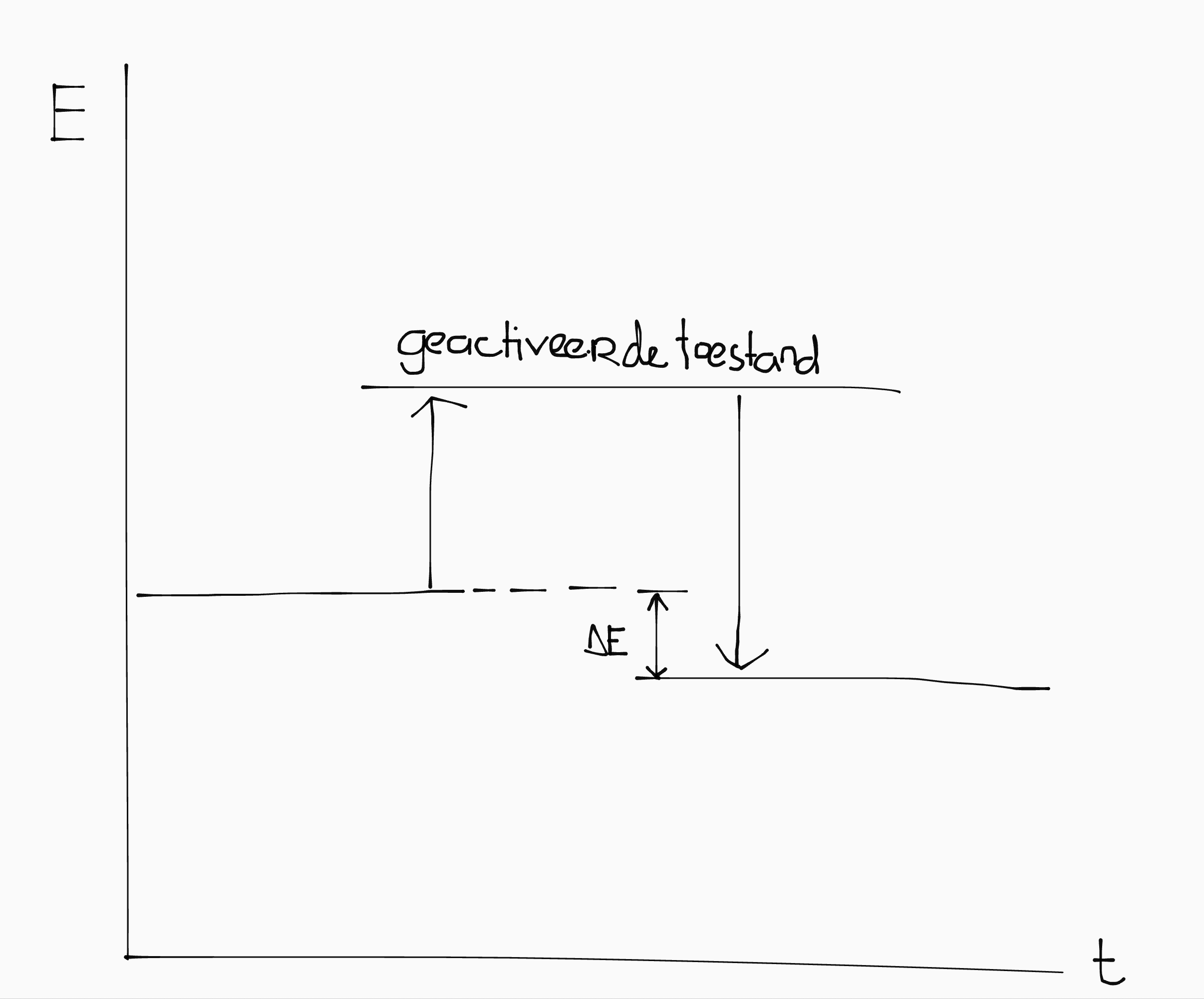 |
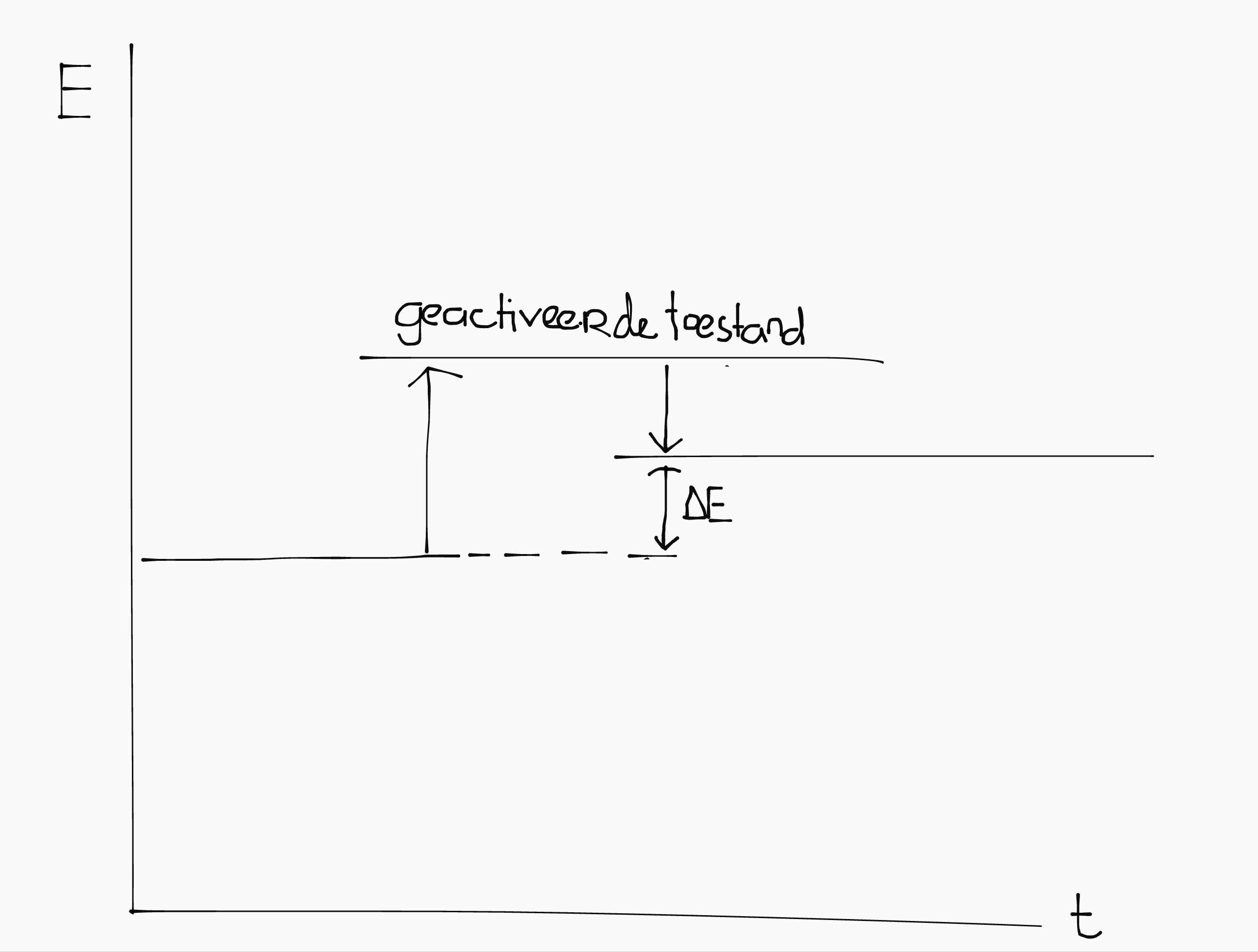 |
| Er komt energie vrij. | Je moet energie toevoeren. |
Reactiesnelheid
De snelheid waarmee een reactie verloopt kan je beredeneren aan de hand van het botsende deeltjesmodel: reacties verlopen als deeltjes effectief botsen. Voor een effectieve botsing moet de botsingsenergie een bepaalde drempelwaarde (de activeringsenergie) overstijgen, anders gebeurt er niks.
Er is dus alleen een reactie als deeltjes vaak en hard genoeg botsen. Als de deeltjes zacht of helemaal niet botsen is er geen reactie. Er zijn een aantal factoren die hier invloed op hebben:
- Hogere concentratie: er zijn meer deeltjes, dus er zijn meer botsingen.
- Verdelingsgraad: er is een groter contactoppervlak, dus er zijn meer botsingen.
- Hogere temperatuur: de deeltjes bewegen sneller, dus ze botsen vaker en harder.
- Katalysator: de activeringsenergie wordt lager, dus botsingen hoeven minder hard.
Een katalysator is een stof die wel wordt gebruikt maar nooit verbruikt. Een homogene katalysator heeft dezelfde fase als de reactieproducten; een heterogene katalysator niet.
Evenwichten
Een evenwichtsreactie is een reactie die beide kanten op verloopt. We geven die aan met een dubbele pijl:
\[\ce{2A + B <=> C + 3D}\]
Je kan evenwichten verschuiven door het reguleren van concentratie, temperatuur of volume. Daarbij gaat het evenwicht altijd in de richting die de verandering tegengaat. Dit noem je het principe van Le Chatelier.
Verschuiven met concentratie
Je kan een evenwicht verschuiven door producten toe te voeren of weg te nemen:
- Als je links een product weghaalt kan de reactie naar rechts niet meer verlopen en zal het evenwicht naar links verschuiven.
- Als je links een product toevoegt kan de reactie naar rechts juist beter verlopen en zal het evenwicht dus naar rechts verschuiven.
Verschuiven met temperatuur
Het evenwicht verschuift ook bij het toevoeren of wegnemen van energie, bijvoorbeeld door het reguleren van de temperatuur:
- Als je de temperatuur verhoogt verloopt de endotherme reactie beter en zal het evenwicht naar de kant met de laagste \(E\) verschuiven.
- Als je de temperatuur verlaagt, verloopt de exotherme reactie beter en zal het evenwicht naar de kant met de hoogste \(E\) verschuiven.
Verschuiven met volume
Als er aan één kant van de vergelijking meer deeltjes ontstaan (in dit voorbeeld rechts), heeft ook het volume invloed op het evenwicht:
- Als je het volume vergroot, verschuift het evenwicht naar de kant met de meeste deeltjes.
- Als je het volume verkleint, verschuift het evenwicht naar de kant met de minste deeltjes.
Evenwichtsvoorwaarde
De evenwichtsvoorwaarde (\(k\)) is een breuk met daarin de reactieproducten, die je kan gebruiken voor berekeningen aan evenwichten. In de evenwichtsvoorwaarden veranderen de coëfficienten in machten en worden alleen producten in gasvorm of \((\text{aq})\) meegenomen.
\[\ce{k = \frac{[C][D]^3}{[A]^2[B]}}\]
\(k\) is constant als het evenwicht ingesteld is, en de waarde van \(k\) hangt af van de temperatuur.
Katalysator
Als je het evenwicht verschuift duurt het even voordat het nieuwe evenwicht ingesteld is. Als je een katalysator gebruikt is deze insteltijd korter.
Reactiemechanismes
Structuurformules
De formules die we tot nu toe gebruikt hebben geven uit welke atomen een molecuul is opgebouwd. We noemen dit molecuulformules:
\[\ce{C3H8}\]
Deze formules geven echter geen inzicht in op welke manier de atomen gekoppeld zijn. Hiervoor gebruiken we structuurformules:
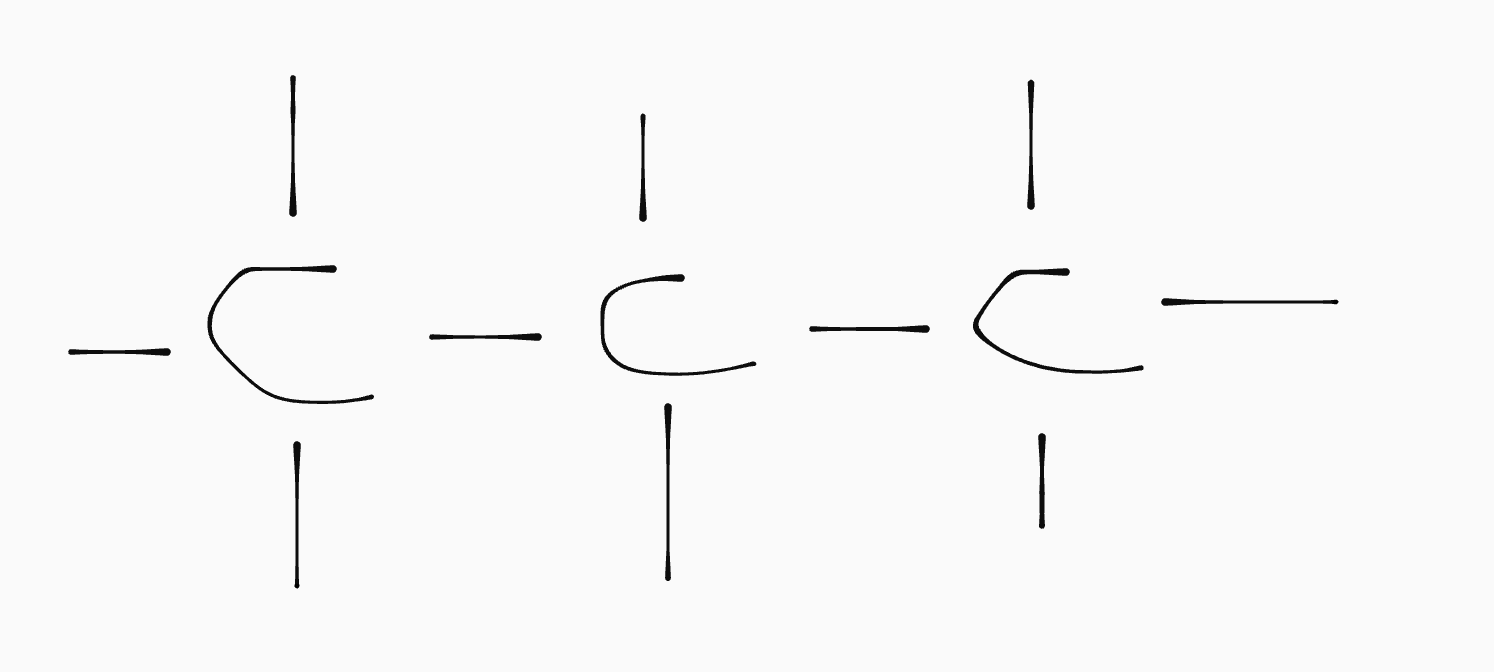
In een structuurformule worden de atomen aangegeven met hun letters en worden atoombindingen aangegeven met streepjes. We hebben afgesproken dat voor een C-H binding de H weggelaten mag worden.
Voor één molecuulformule zijn verschillende structuren mogelijk. Dat noemen we isomerie.
Lewisstructuren
Ongebonden elektronenparen zijn val-e- in het buitenste orbitaal van een atoom die niet onderdeel van een covalente binding zijn:

Reacties tussen stoffen verlopen door het verschuiven van elektronen. Een Lewisstructuur is een notatie om ongebonden elektronenparen weer te geven, om beter te kunnen redenederen over de bewegingen van elektronen:

Mechanismes
Reactiemechanismes zijn schema’s waarin de elektronenstroom die plaatsvindt bij een bepaalde reactie is gevisualiseerd. Hierbij gaan altijd pijlen van een binding of ongebonden elektronenpaar naar een atoom of andere binding.
In mechanismes heb je vaak nucleofiele en elektrofiele deeltjes. Een nucleofiel deeltje wordt aangetrokken door een positieve lading (\(\delta^+\)), en een elektrofiel deeltje door een negatieve lading (\(\delta^-\)).
Koolstofchemie
Alkanen, alkenen en alkynen
Alkanen zijn koolwaterstoffen bestaand uit een koolstofketen volledig omringd met waterstoffen. Ze hebben de algemene formule \(\ce{C_nH_{2n+2}}\).

Bij alkanen bevatten alle koolstofatomen het maximale aantal waterstoffen. Daarom noemen we alkanen verzadigd.
Als de koolstofketen een dubbele binding spreken we van een alkeen. Voor elke dubbele binding kunnen er volgens de regels van covalentie twee waterstoffen minder aan de koolstofketen zitten. Daarom noemen we alkenen onverzadigd.
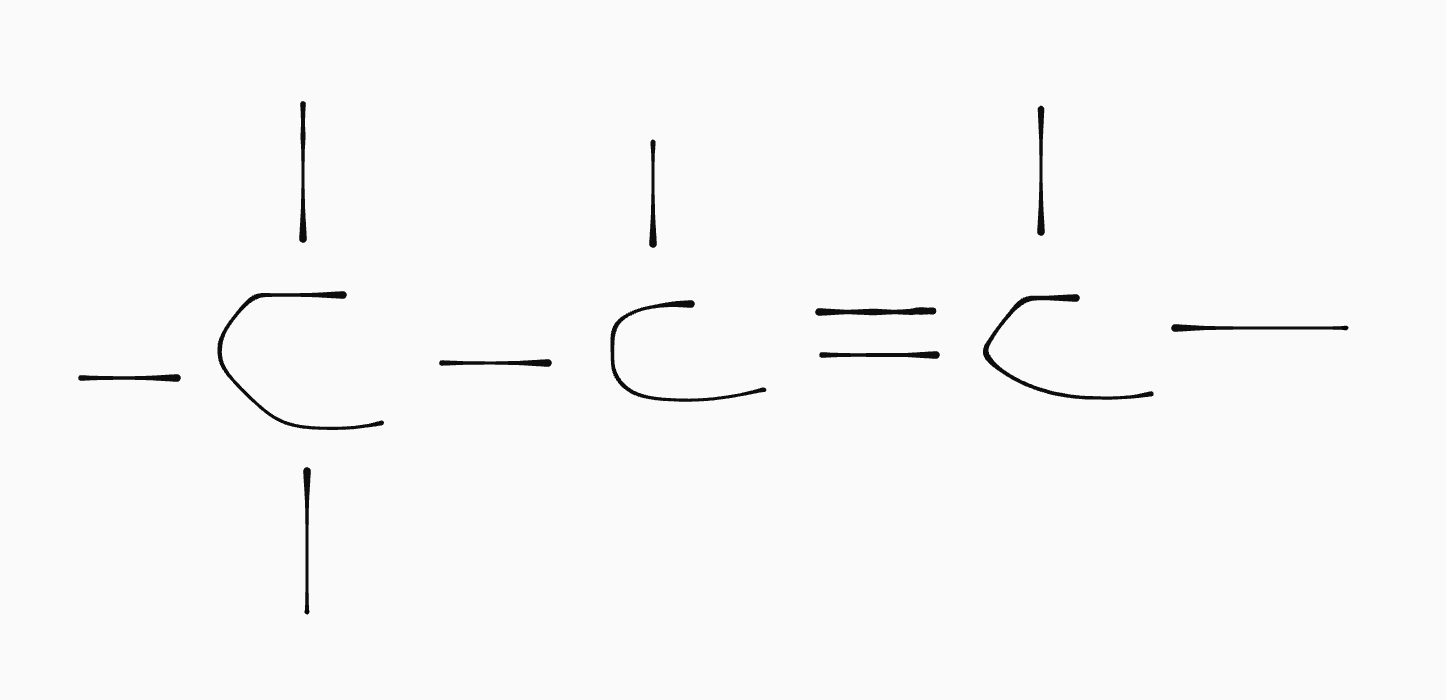
Je kan het aantal dubbele bindingen berekenen aan de hand van de algemene formule.
Voorbeeld
Stel je hebt \(\ce{C6H8}\). De gebruikelijke formule voor hexaan is \(\ce{C6H14}\). Dat betekent dat er \(14 - 8 = 6\) waterstoffen missen; twee per dubbele binding geeft \(3\) dubbele bindingen.Koolstofketens met een driebubbele binding noemen we alkynen. Dan missen per binding vier waterstoffen. Het berekenen van het aantal bindingen is verder hetzelfde als bij alkenen.
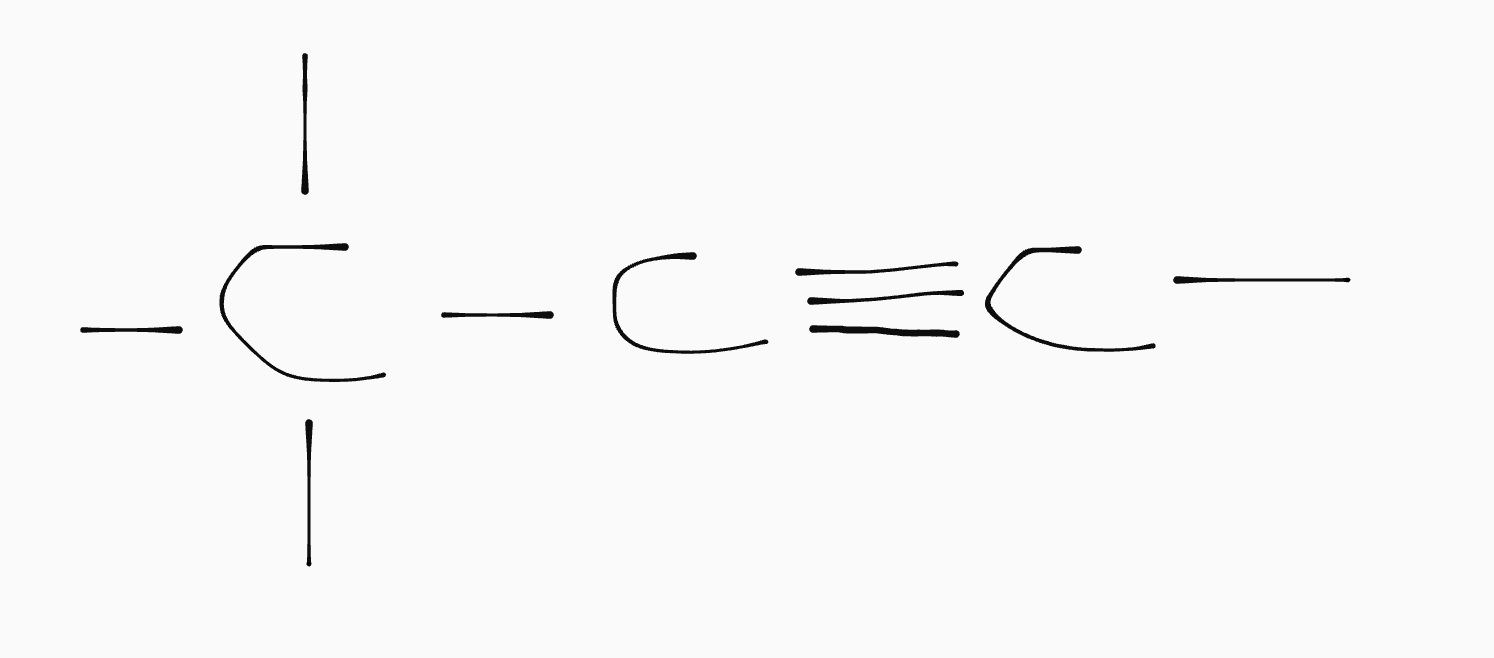
Cycloverbindingen
Als een koolstofketen een ring vormt met zichzelf, noemen we dat een cycloverbinding. Een speciale daarvan is benzeen (\(\ce{C6H6}\)).
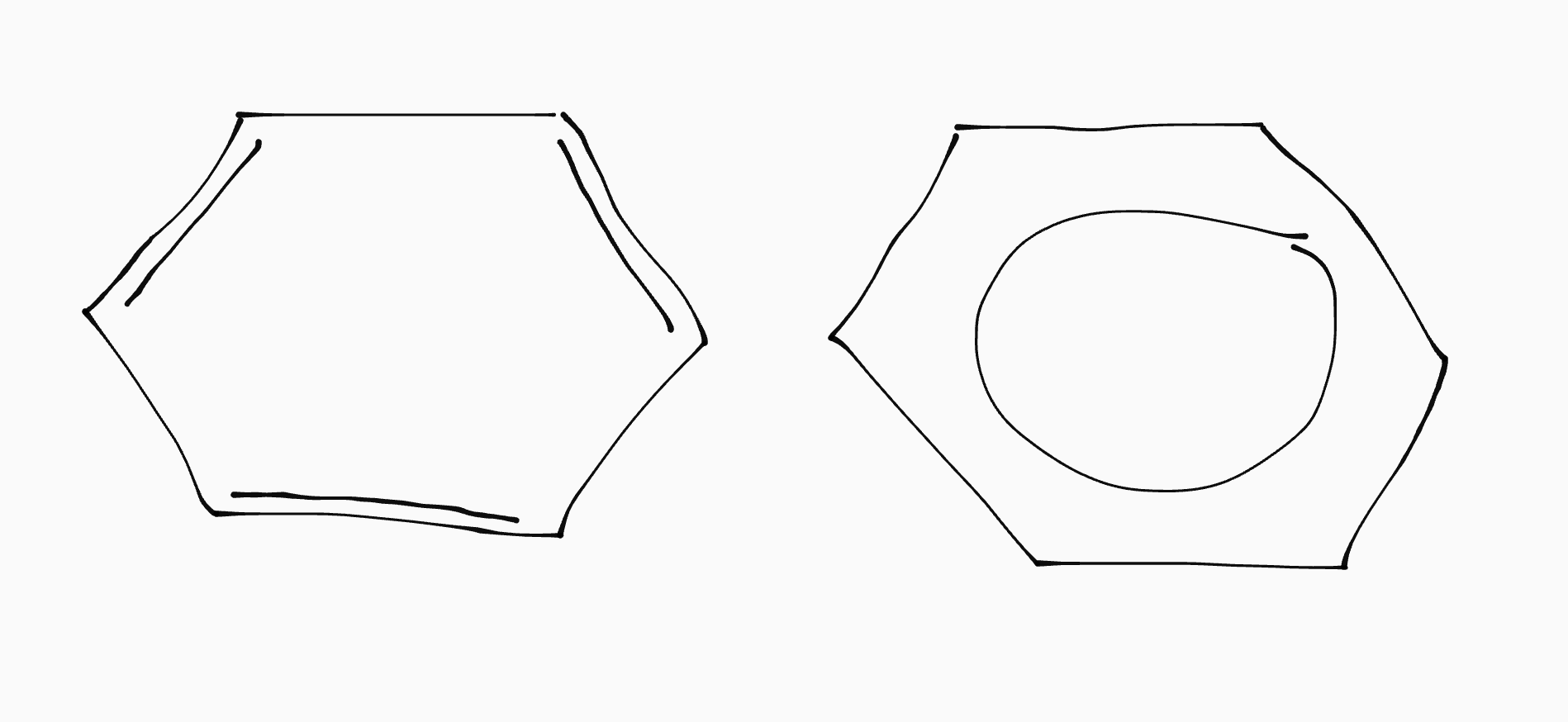
In een benzeenring zitten drie dubbele bindingen die zich continue over de ring verplaatsen. Stoffen met een benzeenring erin noemen we aromaten.
Systematische naamgeving
Om verschillende structuren van elkaar te kunnen onderscheiden gebruiken we systematische naamgeving.
De stamnaam van een stof is altijd de lengte langste koolstofketen. Daarbij krijgen alkaan de uitgang -aan, alkenen -een, en alkynen -yn.
| Stamnaam | meth- | eth- | prop- | but- | pent- | hex- |
|---|---|---|---|---|---|---|
| lengte koolstofketen | 1 | 2 | 3 | 4 | 5 | 6 |
Alle aftakkingen van de hoofdketen noemen we functionele groepen. Voor alle functionele groepen hebben we voor- en achtervoegsels. Je geeft met een getal aan aan welke koolstof de functionele groep vast zit.
| Naam | binding | voorvoegsel | achtervoegsel |
|---|---|---|---|
| (Carbon)zuur | \(\ce{-COOH}\) | - | -zuur |
| Ester | \(\ce{-C=OCO}\) | - | -oaat |
| Peptide | \(\ce{-C=OCNH}\) | - | ?? |
| Aldehyde | \(\ce{=O}\) (einde keten) | oxo- | -al |
| Keton | \(\ce{=O}\) (midden keten) | oxo- | -on |
| Alcohol | \(\ce{-OH}\) | hydroxy- | -ol |
| Amine | \(\ce{-NH2}\) | amino- | -amine |
| Ether | \(\ce{-O-R}\) | [alk]oxy- | - |
| Akyl | \(\ce{-C_nH_{2n + 1}}\) | [alk]yl- | - |
| Halogeen | \(\ce{-F}\), \(\ce{-Cl}\), \(\ce{-Br}\), \(\ce{-I}\) | [halogeen]- | - |
| Nitro | \(\ce{-NO2}\) | nitro- | - |
Je kan dit overzicht ook vinden in Binas 66D. De eerst voorkomende groep (hoogste prioriteit) krijgt het achtervoegsel. De rest van de groepen krijgen voorvoegsels.
Afwijkende naamgeving esters
Esters hebben afwijkende systhematische naamgeving. Estervorming is een reactie waarbij een alcohol met een zuur reageert, waarbij een ester en water ontstaan:
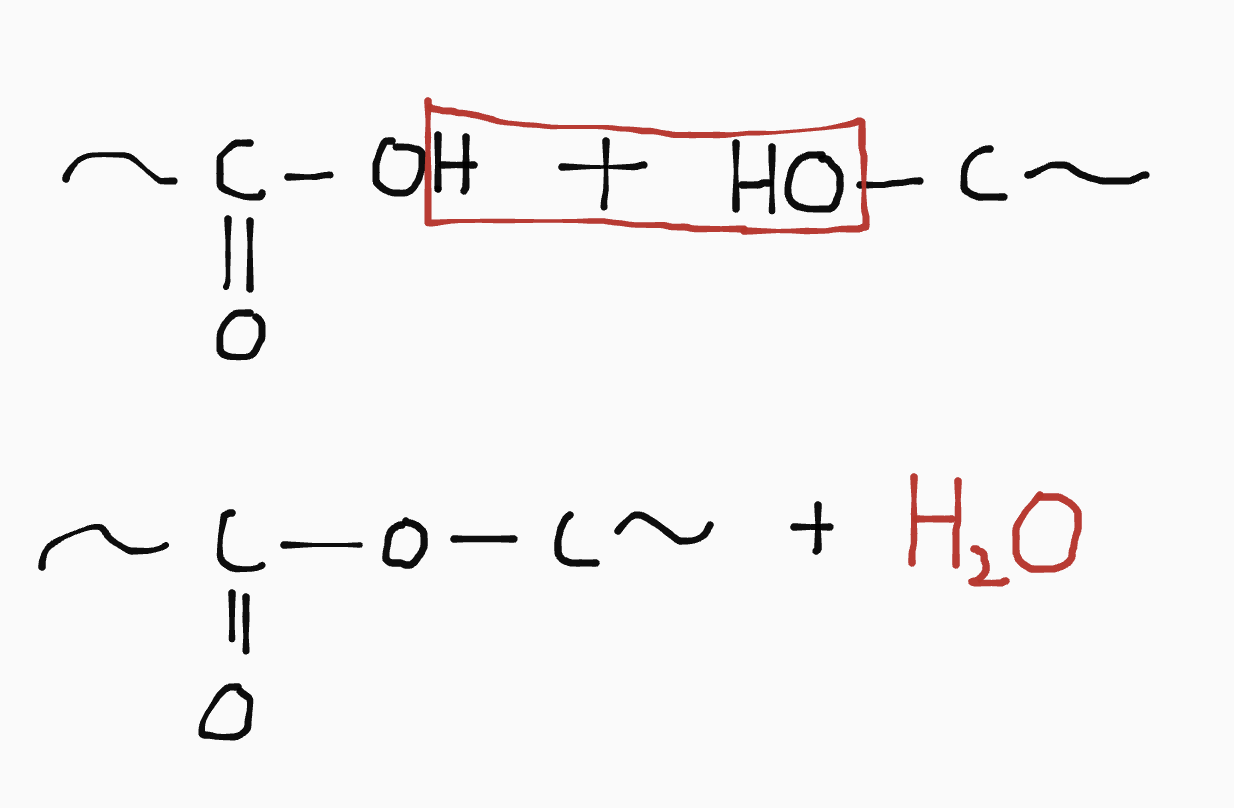
In plaats van de langste koolstofketen, wordt de lengte van de koolstofketen van het originele zuur gebruikt.
Ruimtelijke bouw
In werkelijkheid zijn moleculen natuurlijk niet tweedimensionale structuren. Voor de ruimtelijke bouw (aka VSEPR) zijn drie regels, op basis van het aantal buren dat een atoom heeft. Ongebonden elektronenparen tellen ook mee als buren.
| Aantal buren | naam | bindingshoeken | voorbeeld |
|---|---|---|---|
| 2 | linear | 180° |  |
| 3 | vlak | 120° |  |
| 4 | tetra-eder | 109.5° |  |
Structuur- en stereosomerie
Er zijn twee soorten isomeren:
- Structuurisomeer: zelfde molecuulformule, verschillende structuur.
- Stereoisomeer zelfde structuurformule, andere ruimtelijke bouw.
Stereoisomeren komen voor als er een tetra-eder is met vier verschillende zijgroepen of een dubbele binding met twee aan beide kanten twee verschillende groepen (cis-transisomerie).
Stereocentra worden in de structuurformule aangegeven met een * op het betreffende atoom of de dubbele binding.
\[\text{aantal mogelijke structuren} = 2^{\text{aantal stereocentra}}\]
Isomeren waarbij de moleculen elkaars gespiegelde komen voor bij tetra-eders met vier verschillende groepen. We noemen dit spiegelbeeldisomeren:
| Spiegelbeeld | 180° gedraaid |
|---|---|
 |
 |
In medicijnen is het vaak zo dat de werkzame stof twee spiegelbeeldisomeren heeft: één heeft de geneeskrachtige werking, terwijl het spiegelbeeld juist voor de bijwerkingen zorgt.
Polyverbindingen
Polymeren
Een polymeer is een hele lange koolstofketen opgebouwd uit herhalingen van kleinere stukjes genaamd monomeren. De vorming van een polymeer noemen we condensatie polymerisatie, en verloopt via een estervormingsreactie:
…
Weekmakers
Je kan plastic zachter maken door middel van een weekmaker zoals aceton. De aceton neemt dat de plaats van lucht tussen de koolstofketens in, waardoor de onderlingen vanderwaalskrachten kleiner worden. Daardoor wordt het plastic kleedbaar.

| Thermoplast (smelt bij verhitten) | Thermoharder (smelt niet bij verhitten) |
|---|---|
| Ketens bij elkaar gehouden door relatief zwakke vanderwaalskrachten. | Ketens bij elkaar gehouden door covalente bindingen genaamd crosslinks. |
 |
 |
Kookpunt
Omdat polymeren bestaan uit lange koolstofketens, is de onderlinge vanderwaalskracht relatief groot en zijn ze vast bij kamertemperatuur. Vedere invloed op kookpunt (klein naar groot):
- Lengte keten (vanderwaalskrachten)
- Polariteit (dipool-dipoolinteracties)
- \(\ce{OH}\)- of \(\ce{NH2}\)-groepen (waterstofbruggen)
- Crosslinks (covalente bindingen)
Koolhydraten
Koolhydraten zijn gehydrateerde ringverbindingen van koolstof. Ze kunnen voorkomen als monosachriden of ketens daarvan, genaamd polysachriden.

De monosachriden kan je vinden in Binas 67F. Het zijn allemaal stereoisomeren met de molecuulformule \(\ce{C6H12O6}\). De richting van de \(\ce{OH}\)-groepen aan de roodgekleurde \(\ce{C}\)’s bepaalt wat voor soort koolhydraat het is.
Door de condensatie van twee of meer monosachriden kan je een disachride of zelfs polysachride krijgen. De omgekeerde reactie heet hydrolyse (een ontleding waarbij water verbruikt wordt).

Bij het maken van een keten van \(n\) monosachriden, komen \((n - 1)\) watermoleculen vrij.

De reactie vindt meestal plaats tussen C1 en C4, geteld met de klok mee vanaf de ether. Een polysachride mag ook uit verschillende soorten monosachriden bestaan.
Voor zowel condensatie als hydrolyse zijn enzymen als katalysator nodig. Enzymen werken het best (als katalysator) bij een bepaalde temperatuur en bepaalde pH. Dit verschilt per enzym en stof die moet worden afgebroken of gevormd. Als je zo’n enzym niet hebt, kan je de koolhydraat niet afbreken, zoals bijvoorbeeld bij lactose-intolerantie.
De bekenste polysachride is zetmeel. In planten wordt verder cellulose gemaakt, en in dieren glycogeen.
Vetten en oliën
Vetten en oliën (aka glycerides) bestaan uit glycerol (propaan-1,2,3-triol) en drie vetzuren. Een vetzuur (Binas 67G) is een lange koolstofketen met een zuurgroep op het einde.
De glycerol en vetzuren vormen via een estervorming (\(\ce{\text{alcohol} + \text{zuur} -> \text{ester} + \text{water}}\)) een triglyceride. De omgekeerde reactie heet (net als bij suikers) hydrolyse.

Er zijn 3 soorten vetzuren, gebaseerd op het aantal dubbele bindingen in de koolstofketen:
| Naam | Aantal dubbele bindingen |
|---|---|
| Verzadigd | 0 |
| Enkelvoudig onverzadigd | 1 |
| Meervoudig onverzadigd | 2+ |
Het aantal dubbele bindingen in de staarten van een triglyceride bepaalt of het om een vet of olie gaat. Een verzadigd vetzuur heeft een hoger kookpunt.
- Vetten bestaan uit uitsluitend verzadigde vetzuren en zijn daarom bij kamertemperatuur vast.
- Oliën hebben één of meer onverzadigde vetzuren en zijn daarom bij kamertemperatuur vloeibaar.
Deze grens tussen vetten en oliën is puur theoretisch. In de praktijk heb je een grijze zone waarin je een soort puddingprut hebt die geen vaste stof (vet) is, maar ook niet echt een vloeistof (olie).
Berekenen hoeveel dubbele bindingen een vetzuur heeft
De staart van een vetzuur (dus zonder zuurgroep) volgt de formule \(\ce{C_nH_{2n + 1}}\).
Per dubbele binding verdwijnen er twee \(\ce{H}\)'s. Dus stel \(\ce{C35H65}\). Dit vetzuur heeft drie dubbele bindingen, omdat er \((35 * 2 + 1) - 65 = 6\) \(\ce{H}\)'s missen.
Eiwitten
Eiwitten (aka polypeptides) bestaan uit aminozuren. Een aminozuur heeft altijd een basisstructuur met een restgroep. De restgroep bepaalt welk aminozuur het is. Je kan ze vinden in Binas 67H.

Door de condensatie van twee of meer aminozuren kan je een di-, tri- of zelfs polypeptide krijgen. Dit gaat door middel van peptidevorming (\(\ce{\text{amine} + \text{zuur} -> \text{peptide} + \text{water}}\)). De omgekeerde reactie heet (net als bij suikers en vetten) hydrolyse.

Aminozuren worden nergens opgeslagen, maar afgebroken in de lever. Hierbij ontstaat ureum, zie Binas 67J voor de structuurformule.
Mogelijkheden met verschillende aminozuren
Als je twee verschillende aminozuren als bouwstenen hebt, kan je in totaal 8 verschillende eiwitten met ketenlengte drie maken. Je kan dit berekenen:
\[\text{aantal mogelijke eiwitten} = \text{aantal bouwstenen}^\text{ketenlengte}\]
Mogelijkheden met ruimtelijke bouw
Als je aminozuur een stereocentrum heeft en rekening gehouden moet worden met ruimtelijke bouw, telt het aminozuur mee als meerdere mogelijke bouwstenen in de bovenstaande formule:
\[\text{aantal bouwstenen (per aminozuur)} = 2^\text{aantal stereocentra}\]
Mogelijkheden met alle aminozuren één keer
Als alle aminozuren exact één keer moeten voorkomen in een eiwit, en ruimtelijke bouw geen rol speelt, bereken je het aantal mogelijke eiwitten met de volgende formule:
\[\text{aantal mogelijke eiwitten} = \text{aantal bouwstenen}!\]
Biochemie
Fosfolipiden
Fosfolipiden worden door je lichaam gemaakt voor celwanden. Een fosfolipide is een triglyceride waarbij één vetzuur vervangen is door een fosfaatgroep.
De fosfaatgroep is polair en is daarom hydrofiel. De twee vetzuren vormen lange apolaire staarten, en zijn dus hydrofoob. Fosfolipiden vormen daarom in water een dubbele laag:
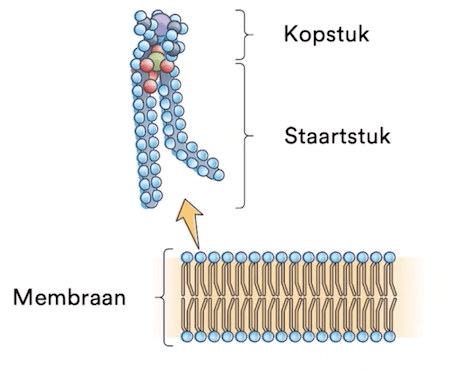
Fosfolipiden met verzadigde vetzuren liggen te dicht tegen elkaar, waardoor stofwisseling moeilijk verloopt. Onverzadigde vetzuren hebben een nét grotere hoek tussen de \(\ce{C=C}\) bindingen, waardoor er meer ruimte is. Daarom zijn onverzadigde vetzuren beter voor je.
Eiwitten ‘opvouwen’ (zie ook Binas 67H)
- Primaire structuur: de normale hoofdketen van animozuren gekoppeld met peptidebindingen.
- Secondaire structuur: waterstofbruggen zorgen ervoor dat de keten wordt ‘opgevouwen’ tot \(\alpha\)-helix of \(\beta\)-sheet.
- Tertiare structuur: de \(\alpha\)-helix of \(\beta\)-sheet wordt verder ‘opgevouwen’ door dipool-dipool interactie en/of zwavelbruggen.
- Quaternaire structuur: de eiwitten wrappen in elkaar, we hoeven niet te weten hoe of waarom dit gebeurt.
Puntmutaties
DNA bevat instructies voor het bouwen van eiwitten. Het DNA is een \(\alpha\)-helix bestaand uit twee strengen: de coderende streng en de matrijsstreng. De strengen bevatten basenparen:
- A-T (verbonden met drie waterstofbruggen)
- G-C (verbonden met twee waterstofbruggen)
Het DNA zit vast in de celkern, maar de eiwitten worden elders in de cel gebouwd. Daarom wordt de coderende streng gekopieerd naar zogenaamd mRNA. Dat is een soort ‘recept’ voor het bouwen van eiwitten.
Het mRNA wordt per codon (drie basen) afgelezen. Op mRNA bestaat de base T niet, en wordt daarom U gebruikt. Elk codon komt overeen met een aminozuur dat ingebouwd kan worden. In Binas 71G staat een overzicht.
In het geval van een puntmutatie is een base in een codon veranderd naar een andere base, waardoor er een ander animozuur geplaatst wordt. Dit kan leiden tot het vroegtijdig afbreken van het eiwit, of de productie van een compleet ander eiwit.
Essentiële vetten & eiwitten
Essentiële vetten en eiwitten kunnen mensen niet zelf maken en moet je dus binnenkrijgen via voeding. Hieronder vallen onder andere meervoudig onverzadigde vetzuren.
Water
Oplosbaarheid
De oplosbaarheid van stoffen wordt bepaald door de polariteit. Apolaire stoffen lossen goed op met andere apolaire stoffen, en polaire stoffen met andere polaire stoffen.
Water is een polaire stof (\(\ce{O}\) is elektronegatief), dus:
- Hydrofiel: polaire stoffen lossen goed op in water
- Hydrofoob: apolaire stoffen lossen slecht op in water
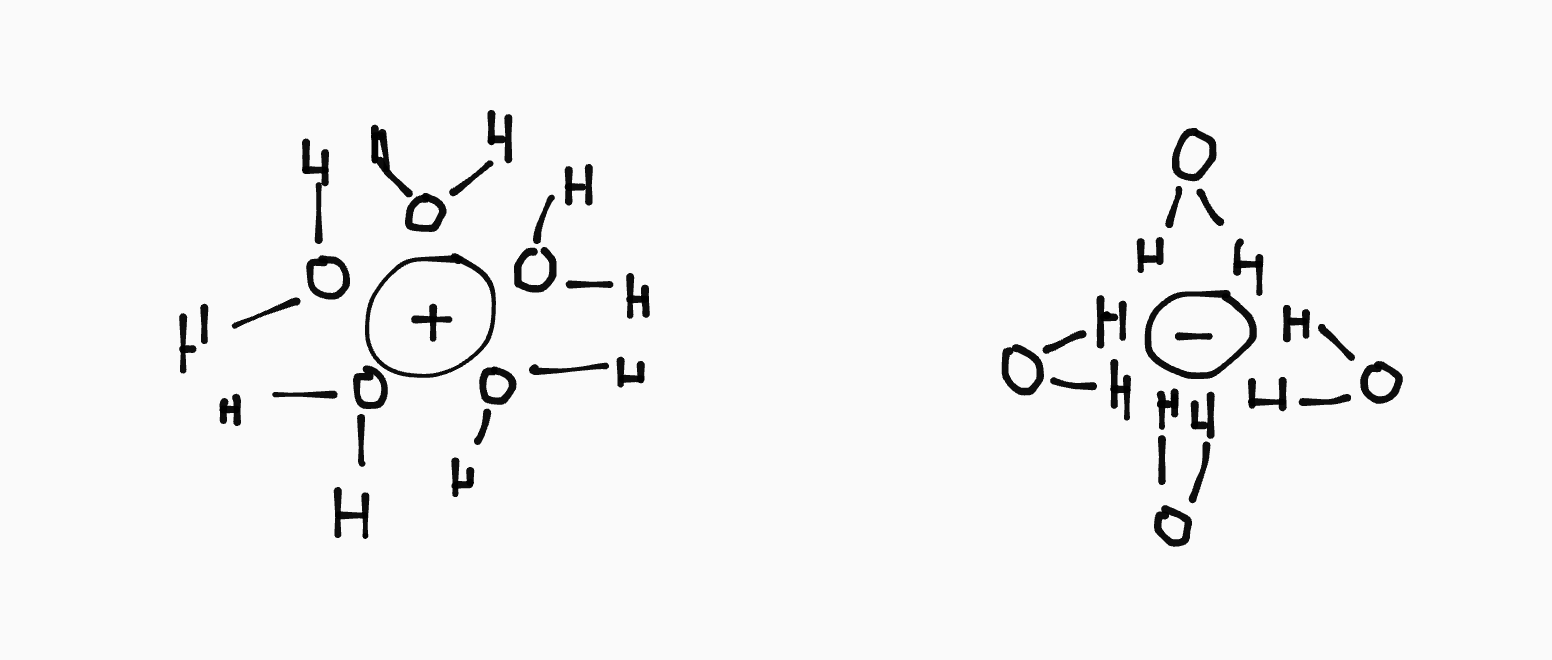
Hydratie
Water is een dipool. De \(\ce{O}\) is \(\ce{\delta-}\) en de \(\ce{H}\)’s zijn \(\ce{\delta+}\). Daardoor worden de ionen in zoutoplossingen omringd met water. Dit noemen we hydratie of gehydrateerde ionen.
Emulgators
…
Groene chemie
Atoomeconomie
De atoomeconomie (Binas 37H) laat zien hoe efficiënt een reactie is. Om de efficiëntie te berekenen gebruik je deze formule:
\[\text{atoomeconomie} = \frac{m_\text{gewenste eindproducten}}{m_\text{beginproducten}} \cdot 100\%\]
Voorbeeld
Stel je hebt de reactie \(\ce{A + B -> C + D}\) om C te produceren. Er blijft altijd A en B over, omdat geen enkele reactie voor 100% verloopt. Er ontstaat ook D, wat voor ons een afvalstof is. De atoomeconomie is dus: \[\text{atoomeconomie} = \frac{m_C}{m_A + m_B} \cdot 100\%\]E-factor
De E-factor (ook Binas 37H) is een manier om de impact van een reactie op het milieu te quantificeren. De E-factor geeft aan hoeveel kilogram afval er ontstaat per kilogram gewenst eindproduct.
\[E = \frac{m_\text{beginstoffen} - m_\text{gewenst eindproduct}}{m_\text{gewenst eindproduct}}\]
Hoe lager de E-factor, hoe beter. In de ideale situatie (\(E = 0\)) ontstaat er helemaal geen afval. Vanaf welke E-factor een reactie “groen” beschouwd kan worden verschilt per situatie. De E-factor wordt dan ook vooral gebruikt voor het vergelijken van productiemethodes.
Zuur-base
Een zuur-base reactie is een reactie waarbij sprake is van waterstofoverdracht. Daarbij kunnen stoffen reageren als zuur of als base. Een zuur geeft \(\ce{H+}\) af, een base neemt \(\ce{H+}\) op.
\[\ce{HZ + B- -> Z- + HB}\]
Sterke en zwakke zuren
Als je een zuur \(\ce{HZ}\) oplost in water, ioniseert deze in \(\ce{H3O+}\) en zijn geconjungeerde base \(\ce{Z-}\).
-
Een sterk zuur ioniseert volledig bij oplossen in water.
\(\ce{HCl_\text{(aq)} + H2O_\text{(l)} -> H3O+_\text{(aq)} + Cl-_\text{(aq)}}\)
-
Een zwak zuur (of geconcentreerd zuur) gaat een evenwicht aan.
\(\ce{HF_\text{(aq)} + H2O_\text{(l)} <=> H3O+_\text{(aq)} + F-_\text{(aq)}}\)
In Binas 49 staan alle zuren en basen. Geconjungeerde zuren en basen staan op dezelfde regel. Als een zuur boven \(\ce{H3O+}\) staat, is het sterk. Als een base onder \(\ce{OH-}\) staat, is het ook sterk.
De sterke zuren noteren we als \(\ce{H3O+ + Z-}\) en zwakke zuren als \(\ce{HZ_\text{(aq)}}\). Basen zijn altijd zouten, en een zout kan niet onvolledig ioniseren; het is oplosbaar of niet. Er is daarom geen onderscheid tussen de notatie van sterke of zwakke basen.
Reacties opstellen
Begin met het noteren van de beginstoffen en vindt het zuur en de base. Zoek deze op in Binas 49. Je hebt nu drie mogelijke situaties:
- Het zuur staat boven de base. Er vindt een aflopende reactie plaats.
- Het zuur staat onder de base. Er vindt geen reactie plaats.
- Het zuur en de base zijn geconjungeerd. Er ontstaat een evenwicht.
Een evenwicht kan alleen ontstaan als oplossing in water.
Meerwaardigheid
Bij een zuur-basereactie kan je te maken hebben met een meerwaardig zuur, dat meerdere \(\ce{H+}\) kan afgeven. Of dat ook echt gebeurt hangt af van de sterkte van het zuur en de base.
Voorbeeld
Stel je hebt \(\ce{CO3^2-}\) een driewaardig zuur zoals \(\ce{H3PO4}\):
\[\ce{H3PO4 + 2CO3^2- <=> HPO4^2- + 2HCO3-}\]
Het zuur geeft dus twee \(\ce{H+}\) af. Maar het kan eigenlijk toch drie \(\ce{H+}\) afgeven?
\[\ce{H3PO4 -> H2PO4- HPO4^2- -> PO4^3-}\]
De voorwaarde is wel dat het zuur dat steeds ontstaat nog steeds boven \(\ce{CO3^2-}\) moet staan in Binas 49. En \(\ce{HPO4^2-}\) staat onder \(\ce{CO3^2-}\) waardoor de laatste \(\ce{H+}\) niet wordt afgegeven.
Dit is alleen van toepassing op zwakke zuren. Een sterk zuur ioniseert volledig, waardoor er maar één reactie met \(\ce{H3O+}\) plaatsvindt.
pH berekenen
(Bij een molariteit van \(\ce{0.100 M}\))
De pH is een schaal van 0–14 die aangeeft hoe zuur of basisch (aka zeepachtig) een oplossing is. Een zure oplossing heeft een lage pH, een basische oplossing een hoge pH. Voor neutrale stoffen zoals water geldt \(\ce{pH} = 7\).
Sterk zuur (\(\ce{H3O+ + Br}\))
- \(\ce{pH = -log [H3O+] = -log(0.100) = 1.000}\)
- Er is geen stap twee.
Significantie
Het aantal significante cijfers van de molariteit is het aantal decimalen van de pH.Zwak zuur (\(\ce{HF_\text{(aq)}}\))
- Stel de oplosvergelijking op: \(\ce{HF + H2O <=> H3O+ + F-}\)
- Stel de evenwichtsvoorwaarde op: \(k_Z = \ce{\frac{[H3O+][F-]}{[HF]}}\)
- Als er \(x\) mol \(\ce{HF}\) reageert, ontstaat er \(x\) mol \(\ce{H3O+}\) en \(\ce{F-}\)
- Vul in en los op: \(k_Z = \frac{x^2}{0.100 - x}\)
- \(\ce{pH = -log [H3O+]} = -\log(x)\)
Base (\(\ce{SO3^2-}\))
- Stel de reactievergelijking op: \(\ce{SO3^2- + H2O <=> OH- + HSO3-}\)
- Stel de evenwichtsvoorwaarde op: \(k_B = \ce{\frac{[OH-][HSO3-]}{[SO3^2-]}}\)
- Als er \(x\) mol \(\ce{SO3^2-}\) reageert, ontstaat er \(x\) mol \(\ce{OH-}\) en \(\ce{HSO3-}\)
- Vul in en los op: \(k_B = \frac{x^2}{0.100 - x}\)
- \(\ce{pOH = -log [OH-]} = -\log(x)\)
- Omrekenen naar pH: \(\ce{pH = 14 - pOH}\)
Omzettingspercentage bij ingesteld pH
- Bereken \(\ce{[H3O+] = 10^{-pH}}\)
- Stel de reactievergelijking op: \(\ce{HF + H2O <=> H3O+ + F-}\)
- Stel de evenwichtsvoorwaarde op: \(k_Z = \ce{\frac{[H3O+][F-]}{[HF]}}\)
- Omschrijven naar: \(\frac{k_Z}{\ce{[H3O+]}} = \ce{\frac{[F-]}{[HF]}}\)
Als naar een verhouding gevraagd wordt ben je klaar. Voor een omzettingspercentage moet je nog één stap doen. Een percentage bereken je met \(\frac{\text{deel}}{\text{geheel}} \cdot 100\%\) en het geheel is \(\ce{[F-] + [HF]}\).
- Als wordt gevraagd hoeveel er is omgezet: \(\text{omz}\% = \ce{\frac{[F-]}{[F-] + [HF]}} \cdot 100\%\)
- Als wordt gevraagd hoeveel er overblijft: \(\text{omz}\% = \ce{\frac{[HF]}{[F-] + [HF]}} \cdot 100\%\)
Buffers
Een buffer is een geconjungeerde oplossing waarbij \(\ce{[HZ] \simeq [Z-]}\). Als aan een buffer zuren of basen worden toegevoegd verandert het pH van de oplossing nauwelijks. Hoe dichter de concentraties bij elkaar liggen, hoe beter de bufferwerking. De bekendste buffer is bloed.
pH berekenen
- \(k_Z = \ce{\frac{[H3O+][Z-]}{[HZ]}}\)
- \(\ce{[H3O+]} = k_Z \ce{\frac{[HZ]}{[Z-]}}\)
- \(\ce{pH = -log [H3O+]}\)
Titraties
Met een titratie kan je de molariteit van een oplossing bepalen.
- Pak met een pipet een beetje van de oplossing (bijvoorbeeld 10mL).
- Gooi hier een indicator bij. Indicatoren vind je in Binas 52.
- Druppel met een buret de geconjungeerde in de oplossing.
- Doe dit tot de kleur van de oplossing begint met omslaan.
- Lees op de buret af hoeveel mL geconjungeerde je hebt toegevoegd.
Van de geconjungeerde weet je de molariteit: \(\ce{[OH-]}\) of \(\ce{[H3O+]}\). Aan de hand daarvan kan je berekenen hoeveel mol van de geconjungeerde je hebt toegevoegd (we gebruiken als voorbeeld een base):
\[n_\text{base} = \ce{[OH-]} \cdot V_\text{afgelezen op buret}\]
Op het omslagpunt geldt \(n_\text{zuur} = n_\text{base}\), omdat \(\ce{H3O+ + OH- -> H2O}\). Aan de hand daarvan bereken je de molariteit van de originele oplossing (we gebruiken als voorbeeld een zuur):
\[\ce{[H3O+]} = n_\text{zuur} / V_{pipet}\]
Indicator kiezen
Bij het toevoegen van de geconjungeerde komt er een punt waarop de pH van de oplossing in één klap omslaat. In de titratiecurve zie je dit als een verticaal lijnstuk.
De gekozen indicator moet een omslagtraject hebben voor ongeveer dezelfde pH waarde. Indicatoren vind je in Binas 52.
| zuur | base | pH omslagpunt | titratiecurve |
|---|---|---|---|
| sterk | sterk | 7 | 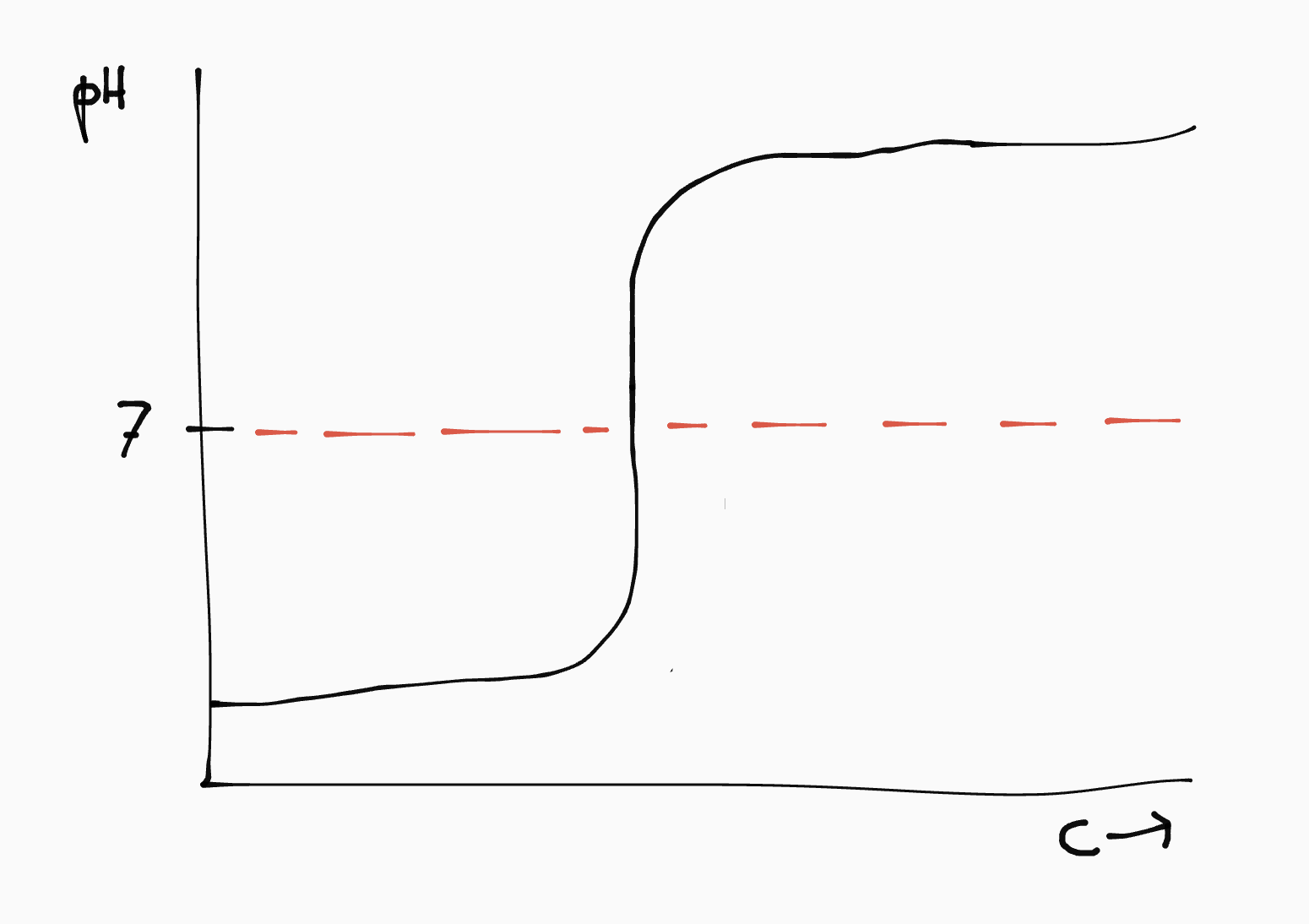 |
| sterk | zwak | < 7 | 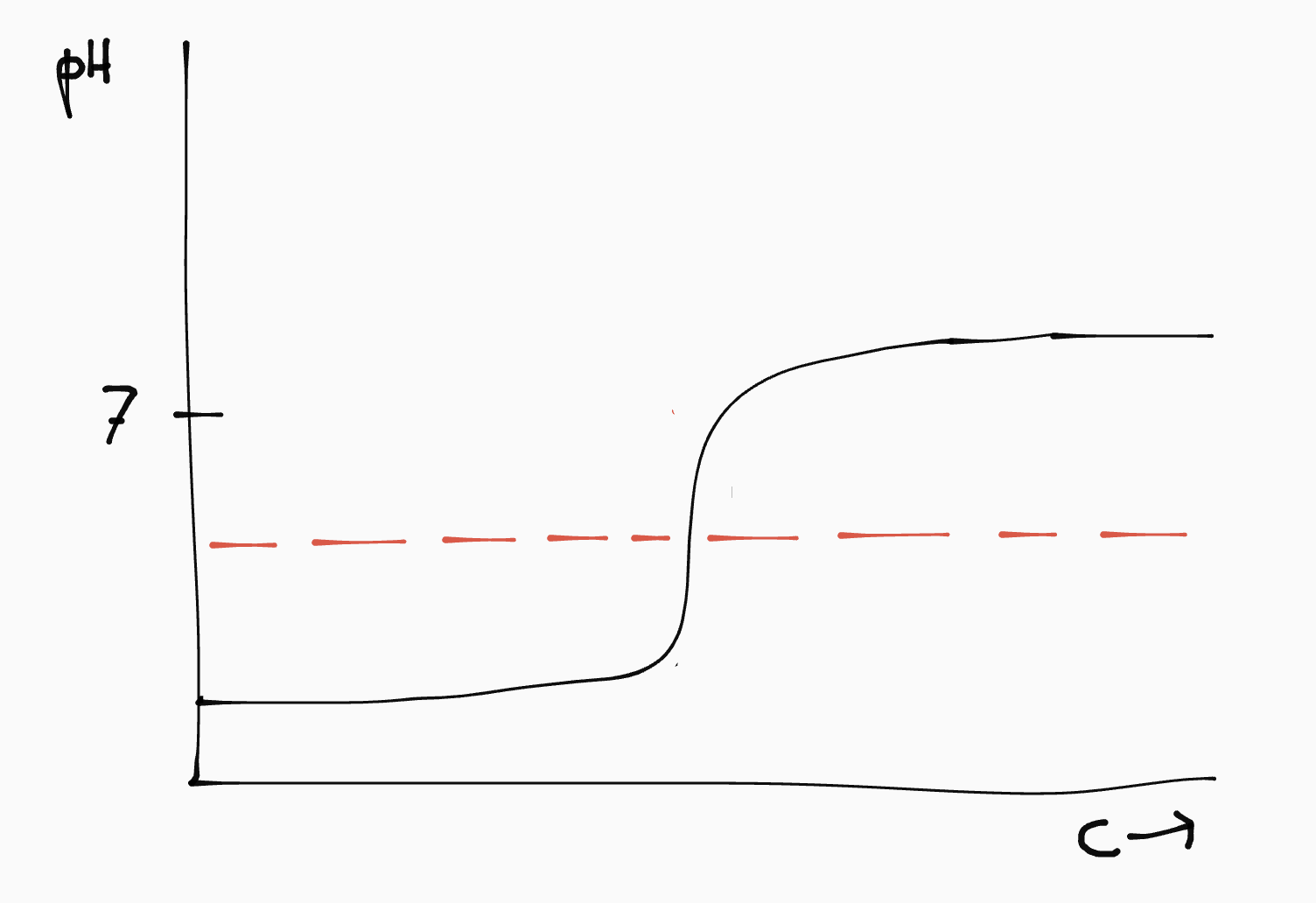 |
| zwak | sterk | > 7 | 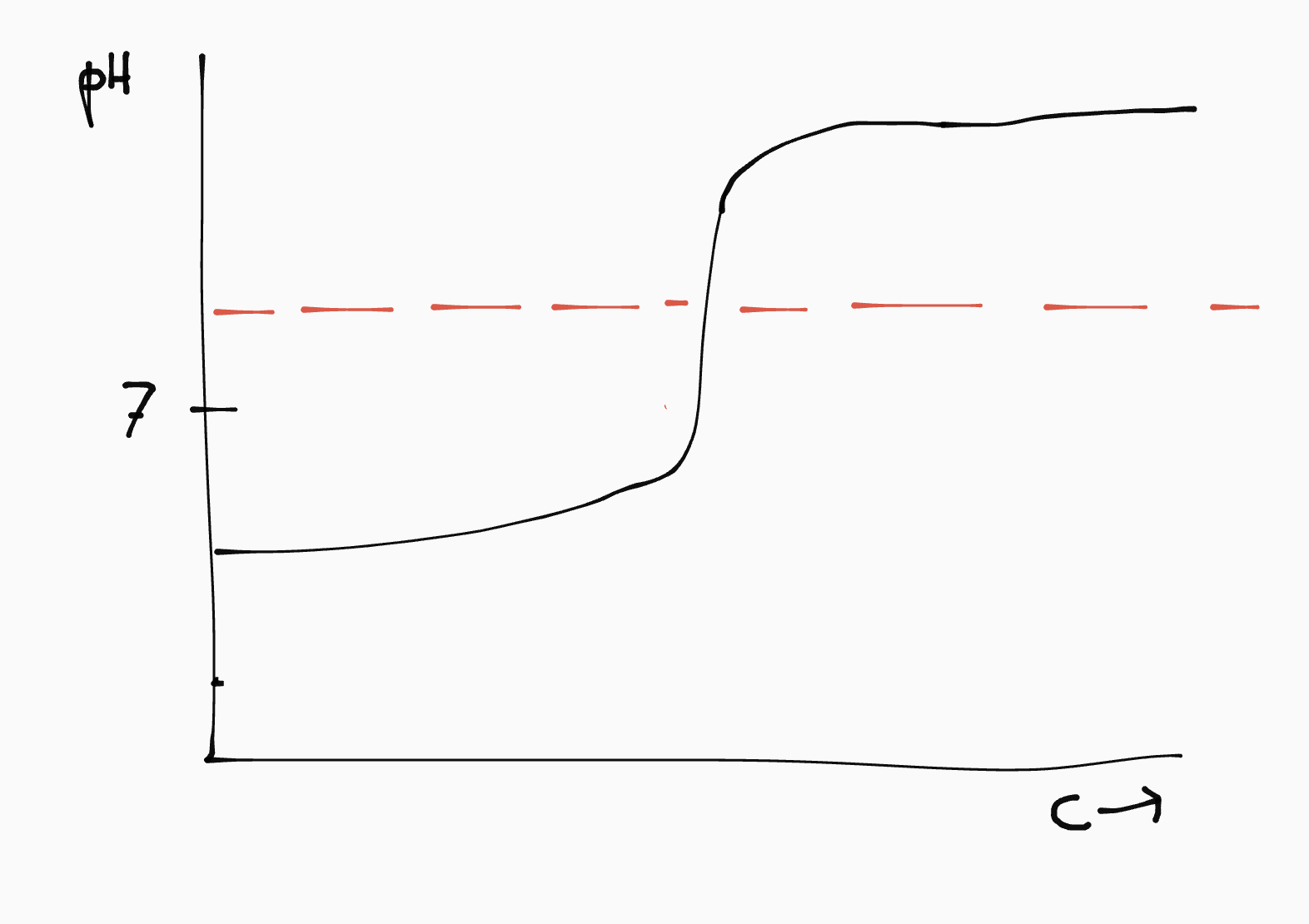 |
Herhalen
Één keer meten is niet meten. Daarom moet je een titratie altijd meerdere keren uitvoeren en het gemiddelde nemen. De buretstanden mogen daarbij niet meer dan 2.5% verschillen. Je berekent de procentuele afwijking zo:
\[\text{afwijking}\% = \frac{\text{verschil}}{\text{totaal}} \cdot 100\% = \frac{|I - II|}{I + II} \cdot 100\%\]
Terugtitraties
Een terugtitratie gebruik je als je te maken hebt met een instabiele stoffen die tijdens de reactie zouden kunnen wegreageren of verdampen (zoals \(\ce{NH3}\)).
- Je voegt een overmaat zuur toe: \(\ce{NH3 + H3O+ -> NH4+ + H2O}\)
- Het grootste deel van het zuur is weggereageerd, maar er blijft een klein deel over: \(n_\ce{NH3} = n_\text{overmaat} - n_\text{over}\)
- Bereken hoeveel mol overmaat je hebt toegevoegd: \(n_\text{overmaat} = \ce{[H3O+]} \cdot V_\text{overmaat}\)
- We gaan \(n_\text{over}\) berekenen door terug te titreren. Gooi een indicator in de oplossing.
- Voeg met een buret \(\ce{OH-}\) toe tot de indicator omslaat.
- Bereken hoeveel mol \(\ce{OH-}\) je hebt toegevoegd: \(n_\text{base} = \ce{[OH-]} \cdot V_\text{buret}\)
- Je weet dat \(n_\text{over} = n_\text{base}\). Bereken hiermee \(n_\ce{NH3}\)
Redox
Een redoxreactie is een reactie waarbij sprake is van elektronenoverdracht. Daarbij kunnen stoffen reageren als oxidator of reductor. Een oxidator neemt elektronen af, een reductor staat elektronen af.
In Binas 48 staan alle oxidators (links) en reductors (rechts) als halfreacties met in de rechterkolom het voltage of standaardelektrodepotentiaal. Dit voltage geeft aan hoe graag een stof elektronen wil afgeven of opnemen.
Hoe hoger een oxidator, hoe sterker. Hoe lager een reductor, ook hoe sterker.
Reacties opstellen
-
Begin met het noteren van de beginstoffen en zoek de sterkste oxidator en reductor in Binas 48. Redoxreacties zijn altijd aflopend en verlopen alleen als \(U_{ox} > U_{red}\).
-
Vermigvuldig beide halfreacties zodat het aantal elektronen in beide reacties gelijk is.
-
Tel de reacties bij elkaar op. Hierbij zouden de elektronen aan beide kanten van de reactiepijl moeten wegvallen. Als dat niet het geval is heb je iets fout gedaan.
Halfreacties opstellen (zonder Binas)
Als een halfreactie niet in Binas 48 te vinden is, kan je deze zelf opstellen.
- Zet beginstoffen voor de pijl en reactieproduct erna. (duh!)
- Maak alle coëfficienten met uitzondering van \(\ce{H}\) en \(\ce{O}\) kloppend.
- Voeg \(\ce{H2O}\) toe aan de kant met de minste \(\ce{O}\)’s.
- Maak de \(\ce{H}\)’s kloppend door \(\ce{H+}\) toe te voegen aan de andere kant.
- Maak de lading kloppend door aan de juiste kant elektronen toe te voegen.
Als je reactie plaatsvindt in een neutraal of zuur milieu ben je klaar. In een basisch milieu:
- Voeg aan beide kanten van de pijl evenveel \(\ce{OH-}\) toe als dat er \(\ce{H+}\) in de reactie staat.
- Daardoor reageert \(\ce{OH- + H+}\) aan één kant van de pijl weg tot \(\ce{H2O}\)
- Aan beide kanten dubbele \(\ce{H2O}\) wegstrepen geeft een kloppende reactie zonder \(\ce{H+}\)
Het kan zijn dat je helemaal niet moeilijk hoeft te doen met \(\ce{H+}\) en \(\ce{H2O}\). Soms ben je al klaar als je de coëfficienten en elektronen kloppend maakt.
Batterij (aka Danielcel)
Een batterij is een redoxreactie op afstand, en zet daarmee chemische energie om in elektrische energie. Een Danielcel bestaat uit:
- Twee zoutoplossingen
- Twee elektrodes
- Een zoutbrug
De sterkste oxidator reageer met de sterkste reductor, zolang \(U_{ox} > U_{red}\). Alle elektrodes mogen meereageren, behalve koolstof (\(\ce{C}\)) en platina (\(\ce{Pt}\)).
Elektronen worden afgegeven door de reductor en opgenomen door de oxidator. We hebben afgesproken dat stroom van plus naar min loopt, maar de elektronen van min naar plus. De reductor is dus de minpool (aka anode) en de oxidator fungeert als pluspool (aka kathode).
De zoutbrug zorgt ervoor dat er ionen uit de zoutoplossingen mee kunnen bewegen met de elektronen, zodat de lading aan beide kanten van de batterij gelijk blijft.
Bij het opladen van de reactie vindt dezelfde reactie plaats, maar lopen de elektronen de tegengestelde richting op. Daarom zijn dan de anode en kathode ook omgedraaid.
Elektroliet
In andere soorten batterij (zoals bijvoorbeeld knoopcellen) wordt vaak elektroliet gebruikt. Dat heeft drie functies:
- Het scheidt de elektrodes van elkaar.
- Het fungeert als zoutbrug.
- Het kan meereageren in de redoxreactie.
Brandstofcel
Een brandstofcel is een speciaal soort batterij voor gebruik in waterstofmotoren. In een reguliere verbrandingsmotor is waterstofgas zeer explosief:
\[\ce{2H2 + O2 -> 2H2O + \text{BOOM!}}\]
In een brandstofcel wordt deze reactie opgedeeld in twee halfreacties:
- \(\ce{H2 -> 2H+ + 2e-}\) met \(U_{red} = 0.00\text{V}\)
- \(\ce{O2 + 4H+ + 4e- -> 2H2O}\) met \(U_{ox} = 1.23\text{V}\)
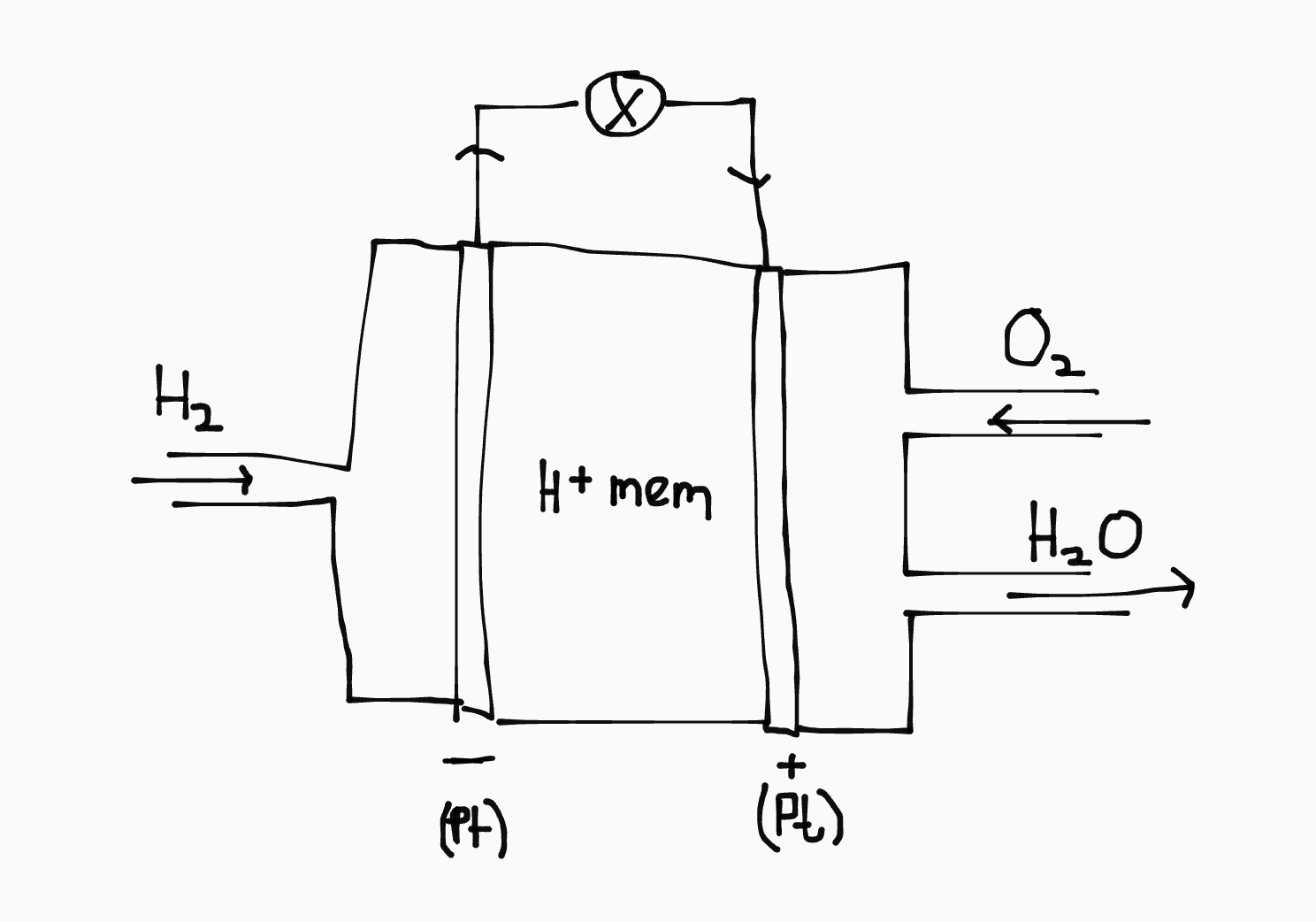
De totaalreactie wordt dan: \(\ce{2H2 + O2 -> 2H2O}\)
Dit is mogelijk dankzij het gebruik van een \(\ce{H+}\)-doorlatend membraan. Daardoor komen het waterstofgas en zuurstof nooit in direct contact.
Reacties
Oxidatie
Een verbranding of oxidatie is een reactie met zuurstof. Een verbranding gaat gepaard met vuurverschijnselen, een oxidatie niet.
Verbranding kan alleen plaatsvinden als aan drie voorwaarde wordt voldaan:
- Voldoende brandstof
- Ontbrandingstemperatuur
- Aanwezigheid van zuurstof
Een explosie vindt plaats bij exact de juiste verhouding van brand- en zuurstof, waardoor in één klap alle brandstof verbrandt. Hierbij komt heel veel energie vrij.
| Brandstof | Verbrandingsproduct |
|---|---|
| \(\ce{H}\) | \(\ce{H2O}\) |
| \(\ce{C}\) | \(\ce{CO2}\) |
| \(\ce{S}\) | \(\ce{SO2}\) |
Ontleding
Een ontledingsreactie is een reactie waarbij een stof wordt gereduceerd tot losse bestandsdelen.
- Fotolyse: onder invloed van licht.
- Electrolyse: onder invloed van elektriciteit.
- Hydrolyse: een ontledingsreactie met water.
Condensatie
Een condensatiereactie is een reactie waarbij een stof gevormd wordt en water vrijkomt. Dit is het tegengestelde van een hydrolyse—waar een stof ontleedt wordt en water vérbruikt wordt.
Als er een polymeer gevormd wordt noemen we dat condensatie polymerisatie.
Additie
Een additiereactie is een reactie waarbij een dubbele binding wordt opengeklapt om een (waterstof)halogeen in te bouwen. Deze reactie wordt gebruikt om koolstofketens te verzadigen.
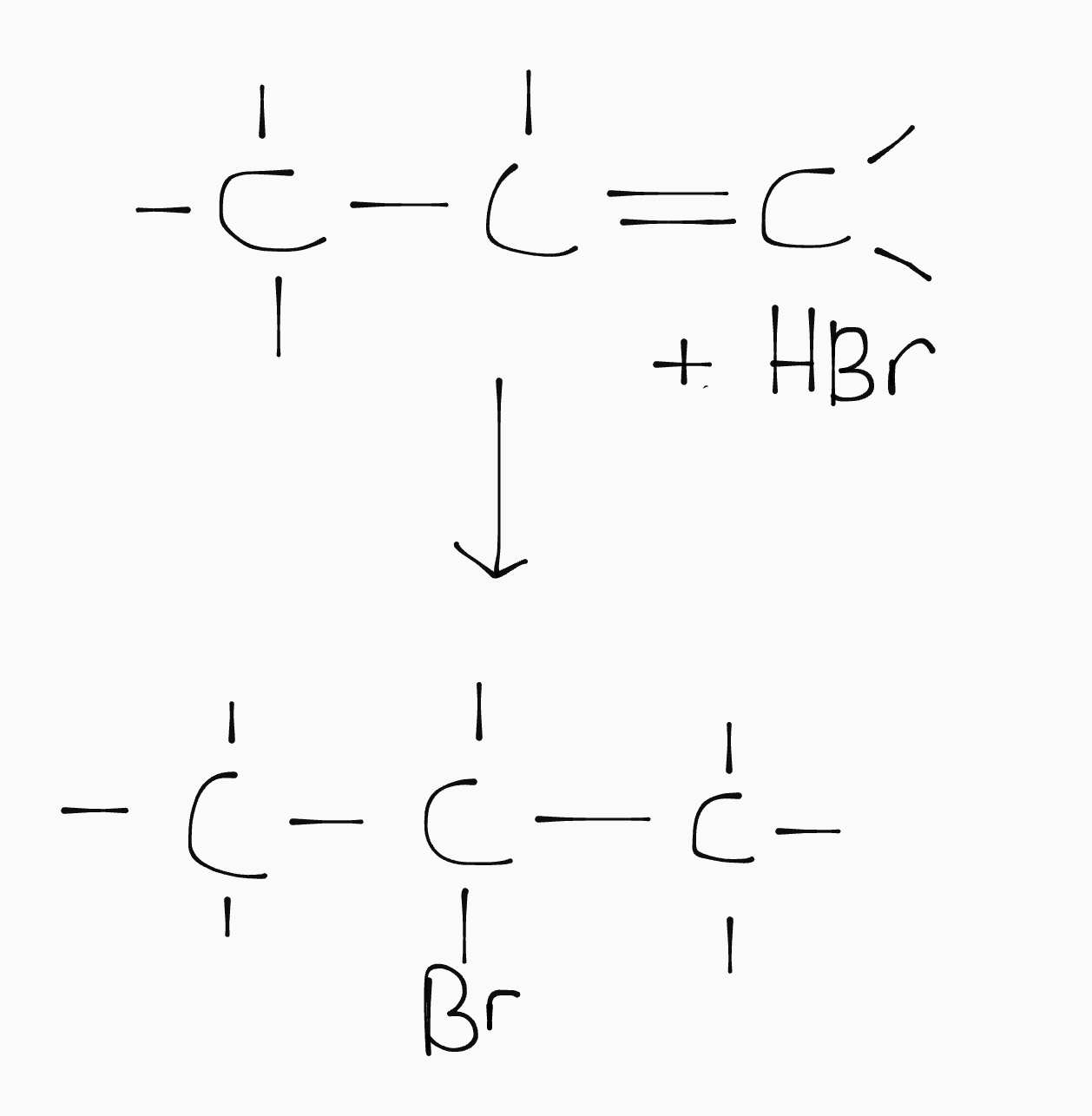
Eliminatie
Een eliminatiereactie is een omgekeerde additie. Bij een eliminatie wordt een (waterstof)halogeen afgestoten om een dubbele binding te vórmen:
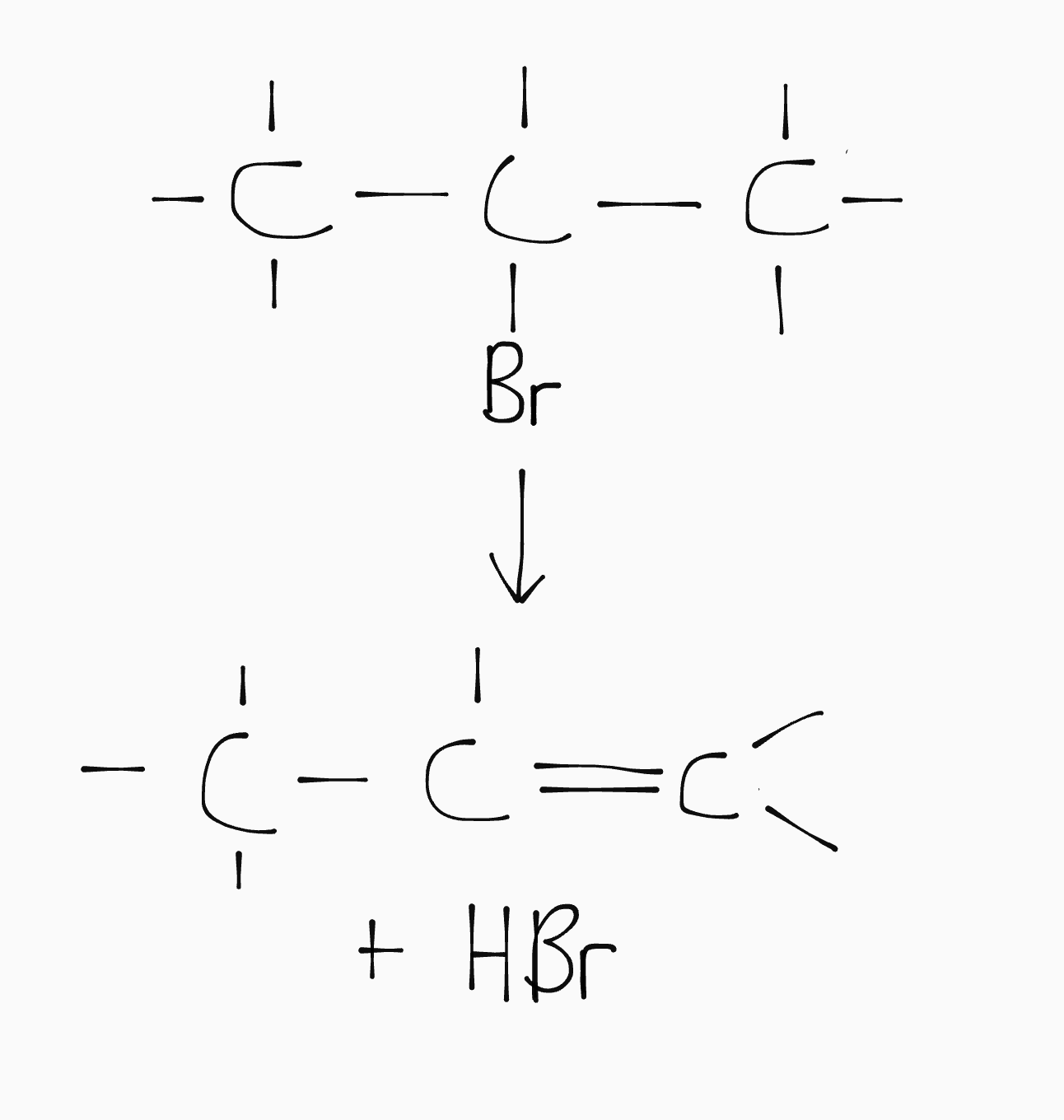
Substitutie
Bij een substitutiereactie wordt een waterstof vervangen met een halogeen. Daarbij ontstaat een waterstofhalogeen:
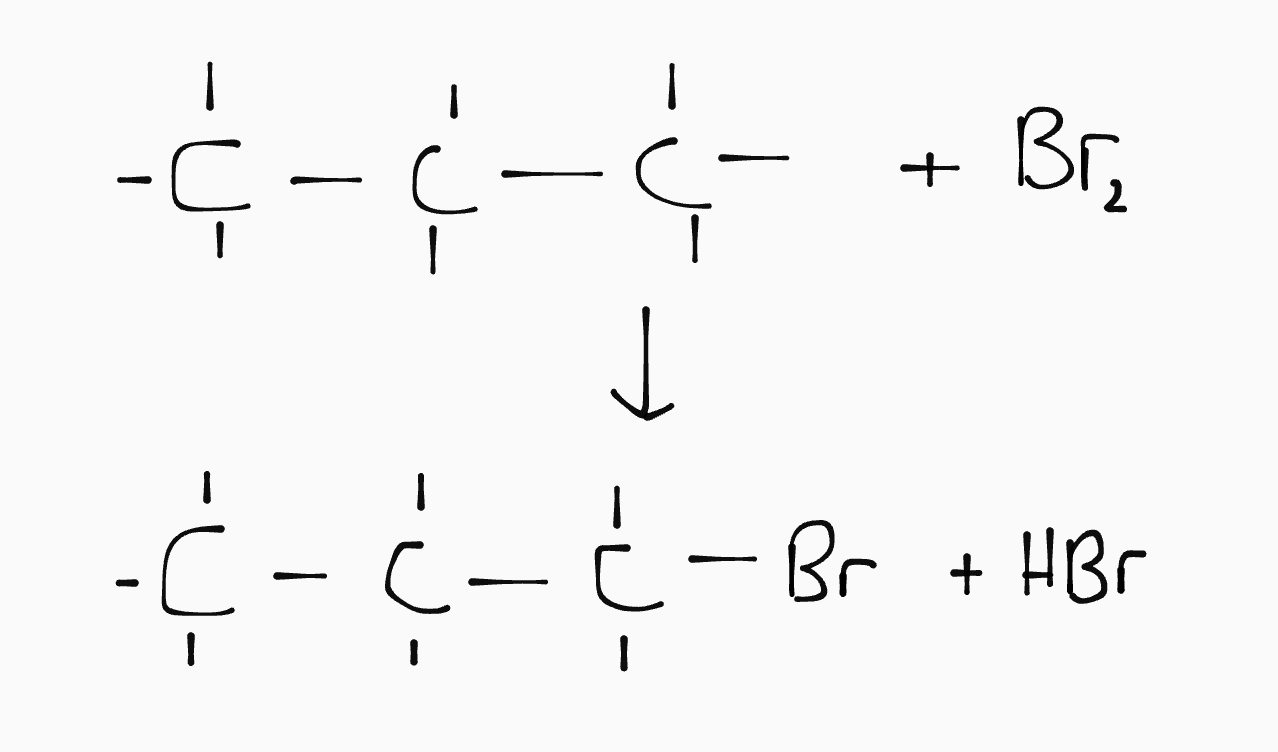
Ester- en peptidevorming
Een estervormingreacties is een reactie waarbij een alcohol met een zuur reageert, waarbij een ester en water ontstaan:
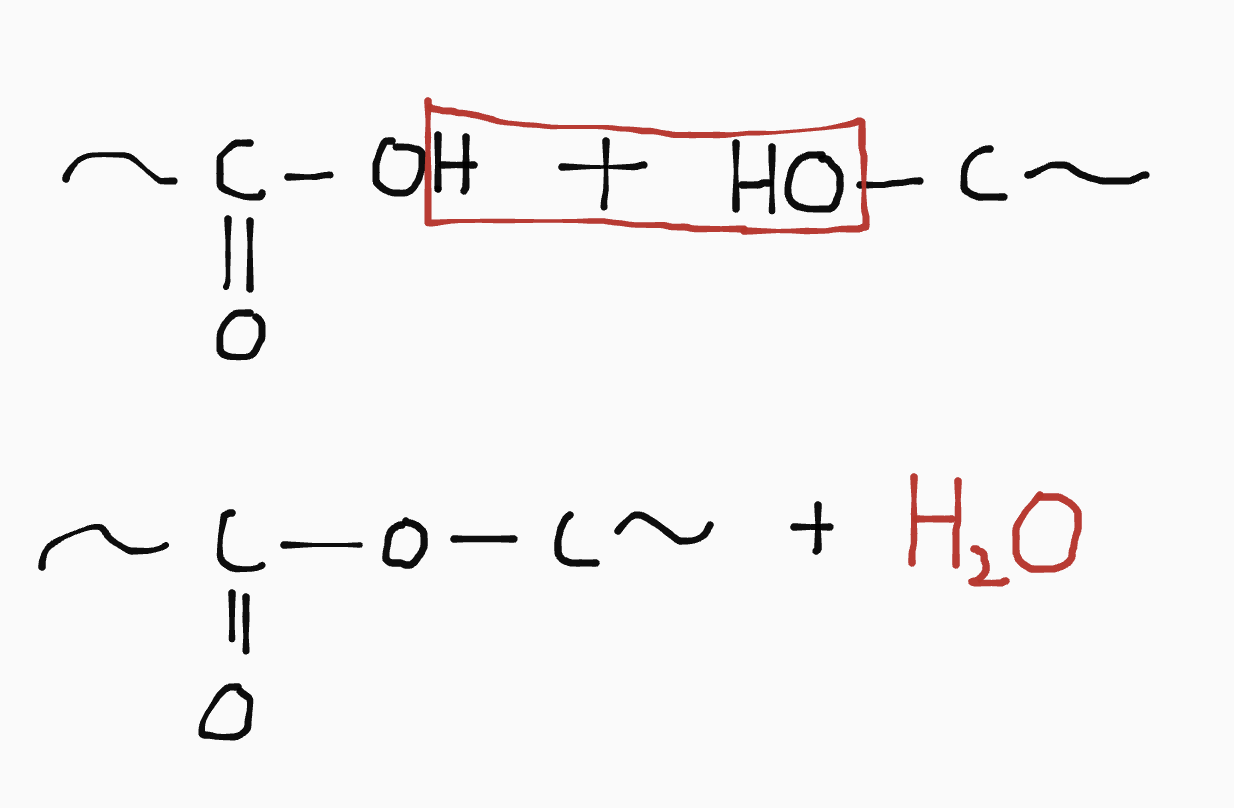
Een peptidevormingsreactie is een reactie waarbij een alcohol met een zuur met een amine reageert, waarbij een peptide en water ontstaan:

De naamgeving van peptides hoeven we voor het examen niet te weten.
Vetharding
Vetharding is een alternatieve naam voor een additiereactie bij vetzuren. Je kan een olie in een vet veranderen door de onverzadigde vetzuren te verzadigen met waterstoffen.
Daarbij haal je de dubbele bindingen weg door middel van additie. Daarvoor is per dubbele \(\ce{C=C}\) binding één \(\ce{H2}\) nodig.
Verzeping
Verzeping is een process waarbij het vet glyceryltristearaat wordt omgezet in een zeep genaamd natriumstearaat (\(\ce{Na+C17H35COO-}\)). Daarvoor voeg je natronloog toe:

Na het scheiden van de glycerol houdt je een natriumstearaat-oplossing over.
Omesteren
Met een omesteringsreactie kan je moeilijk verbrandbare triglycerides (zoals gebruikt frituurvet) omzetten in biodiesel. Voor deze reactie is \(\ce{OH-}\) nodig als katalysator.
\[\ce{\text{triglyceride} + 3 \text{methanol} -> \text{glycerol} + 3 \text{biodiesel}}\]
Een triglyceride is een te groot molecuul om te kunnen verbranden. Bij omesteren worden de staarten veresterd met \(\ce{CH3}\) in plaats van glycerol. Die kleinere moleculen zijn wél makkelijk te verbranden.
Voor omesteren heb je eerst \(3 \cdot \ce{CH3O-}\) nodig:

Je bewaart de ontstane \(\ce{H2O}\), omdat je die aan het eind van de reactie nog nodig hebt. De gevormde \(\ce{CH3O-}\) gaat een zuur-base reactie aan met de triglyceride:

Hierbij worden dus de staarten losgemaakt van de glycerol. De afgesplitste staarten zijn geen vetzuren, want ze hebben geen zuurgroep meer.
Door nu nog de drie eerder opgevangen watermoleculen te laten reageren met het restmolecuul, krijg je weer een glycerol en \(3 \cdot \ce{OH-}\) terug:

Analysemethoden
- Kwantitatieve analysemethoden stellen vast hoeveel je ergens van hebt.
- Kwalitatieve analysemethoden stellen vast wat je precies hebt.
Titratie (kwantitatief)
Met een titratie of terugtitratie bepaal je de molariteit of pH van een onbekende oplossing. Zie zuur-base.
Colorimetrie (kwantitatief)
| Ion | Kleur |
|---|---|
| \(\ce{Cu^2+}\) | blauw |
| \(\ce{Fe^2+}\) | groen |
| \(\ce{Fe^3+}\) | bruin |
Bij colorimetrie wordt op basis van de kleur van een oplossing de concentratie bepaald. Een \(\ce{Cu^2+}\)-oplossing met een hogere concentratie is namelijk donderder blauw.
Hiervoor wordt (wit) licht door de oplossing geschenen, en gekeken hoeveel blauw we oppikken. Hiervoor mag het licht zelf natuurlijk niet ook blauw bevatten, dus wordt er een kleurfilter van tegengestelde kleur (monochromator) gebruikt.
Eerst wordt van een reeks oplossingen met bekende concentratie de extinctie (aka hoeveelheid kleur) bepaald. Op basis daarvan stellen we een ijklijn op die we kunnen gebruiken om aan de hand van een gemete extincitie de molariteit van een onbekende oplossing te bepalen.
Gaschromatografie (kwantitatief & kwalitatief)
Met gaschromatografie kan je de samenstelling van een gasmengsel vast stellen door deze met behulp van een gasstroom (van edelgas, want dat reageert niet) door een kolom te duwen.
De buis waardoor je de stof duwt kan polair of apolair zijn. Je gasmengsel gaat het snelst door een kolom van tegengestelde polariteit. (Want gelijke polaireit trekt elkaar aan, en daardoor wordt het gasmengsel door de wanden van de buis afgeremt.) Aan het einde van de buis meet je de retentietijd: de tijd die het sample erover deed om door de kolom te gaan.
Dus een polaire kolom met een apolair sample of een apolaire kolom met een polair sample resulteert in een lage retentietijd. Andersom is de retentietijd juist lang.
Je kan vervolgens een V,t-diagram maken. Daarin wordt het (deel)volume van het gasmengsel uitgezet tegen de retentietijd. De pieken geven de polariteit van de stoffen in je mengsel aan.
Deze methode is zowel kwantitatief als kwalitatief:
- Op basis van de retentietijd (voor een bekende kolom) kan je de soort stof bepalen.
- De oppervlakte onder de grafiek geeft aan hoeveel volume% van het gasmengsel per stof.
IR-spectraalanalyse (kwalitatief)
Bij een IR-spectrum schijn je infraroodstraling door een stof heen. Op basis van de intensiteit van de IR-straling die de stof voor elke frequentie doorlaat (de transmittance) kan je bepalen welke functionele groepen de stof heeft.

Dit heeft te maken met buig- en strekbindingen, maar dit wordt verder niet in het examenprogramma behandeld.
Massaspectrometrie (kwalitatief)
Massaspectrometrie werkt door het beschieten van een stof met deeltjes. Daardoor worden bindingen weggeschoten en wordt de stof gesplitst in een aantal ionen.
Je krijgt een spectrum met pieken bij de molecuulmassa’s van de losse stukjes. De hoogte van de piek geeft aan hoeveel van die stukjes er procentueel in het sample zaten.

De meest rechter piek is altijd de volledige stof; die piek is klein omdat er maar weinig moleculen helemaal niet geraakt worden.
Isotopen
Het kan zijn dat je voor één atoomsoort meerdere pieken krijgt, vanwege isotopen. De hoogte van de piek is dan het voorkomen in de natuur.